
Harmonia axyridis (Pallas, 1773)
biedronka azjatycka
Harlequin Ladybird |   | Rodzina | | Coccinellidae biedronkowate | | Rząd | | Coleoptera chrząszcze | | Gromada | | Insecta owady | | Typ | | Arthropoda stawonogi | | |
 | |  | | | | | | | | |
 | | | | | | Pierwotna ojczyzna gatunku | | Wschodnia Azja od Ałtaju i wschodniej Syberii po Japonię, Tajwan i południowe Chiny. | | | | | | Podstawowe cechy morfologiczne | | Biedronka azjatycka jest owalnym, silnie wypukłym chrząszczem o długości 5-8 mm i szeokości ok. 5 mm. W Polsce jest jednym z większych przedstawicieli rodziny, zbliżonym wielkością do biedronki siedmiokropki Coccinella septempunctata L. Charakteryzuje się dużą zmiennością w ubarwieniu ciała, w tym w liczbie i wielkości plam na pokrywach. Najczęściej spotykane formy mają żółto-pomarańczowe pokrywy ze zmienną (do 20) liczbą czarnych plamek, lub pokrywy są czarne, z 2-4 pomarańczowo-czerwonymi plamami. Pomiędzy tymi typami istnieje cały szereg form przejściowych; występują też okazy o prawie całkowicie czarnych lub czerwonawych pokrywach. Cechą charakterystyczną jest poprzeczna, wypukła fałda, znajdująca się przed końcem każdej pokrywy. Poniżej tej fałdy występuje dodatkowo dołkowate zagłębienie, co odróżnia ją od nieco mniejszej Adalia decempunctata (L.). Przedplecze u jasnych form również jest jasne, z pięcioma czarnymi plamami zlewającymi się zwykle w przepaskę w kształcie litery M. U ciemno ubarwionych okazów przedplecze jest ciemne, z mniej lub bardziej jasnymi brzegami bocznymi. Głowa, czułki i nogi są najczęściej jasne. Larwy dochodzą do 11 mm długości (w czwartym stadium). Są czarne z pomarańczowymi plamami, przy czym w drugim stadium pomarańczowe ubarwienie obejmuje pierwszy lub pierwszy i drugi segment odwłoka, a w trzecim i czwartym stadium plama obejmuje pierwszy segment odwłokowy i boczne części segmentów 2-5. | | | | | | Biologia, ekologia | | Wczesną wiosną - według Kocha (2003) - samice składają na roślinach pakiety jaj, z których po kilku dniach wylęgają się larwy. W czasie 2-3 tygodni żerowania larwy rosną i trzykrotnie linieją. Czwarte stadium larwalne przepoczwarcza się, a po 4-5 dniach z poczwarki wychodzi owad doskonały. Całość cyklu rozwojowego trwa 2-4 tygodnie, w zależności od temperatury i dostępności pokarmu. W środkowoeuropejskich warunkach klimatycznych H. axyridis wydaje zwykle 2 pokolenia w ciągu roku, jakkolwiek z pracy Kocha (2003) wynika, że może ich być nawet 4-5. Owady dorosłe żyją średnio 30-90 dni (maksymalnie do 3 lat). Jesienią imagines podejmują długodystansowe loty w poszukiwaniu miejsc do przezimowania, wyszukując miejsca, gdzie w stadium diapauzy przeczekają do wiosny, często w bardzo licznych zgrupowaniach. Na zimowanie wybierane są miejsca ciepłe, nasłonecznione, np. jasne ściany budynków o południowej i zachodniej wystawie.
Zarówno larwy, jak i owady dorosłe są drapieżne i polują w tych samych środowiskach. Ich łupem padają głównie różne gatunki mszyc, ale też inne drobne stawonogi, w tym biedronki innych gatunków w różnych stadiach rozwojowych. Jak podaje Koch (2003) dorosła biedronka zjada dziennie 15-65 mszyc, natomiast jedna larwa może w trakcie swego rozwoju zjeść ok. 400 mszyc. Pokarmem zastępczym i/lub uzupełniającym może być pyłek kwiatowy i sok dojrzałych owoców. Duży udział tego pokarmu w diecie prowadzi jednak do wydłużenia cyklu rozwojowego biedronki i skutkuje mniejszą ilością składanych jaj przez samicę (Berkvens i in. 2008). Żeruje głównie na drzewach i krzewach liściastych, ale może też atakować mszyce związane z drzewami iglastymi.
Biedronka azjatycka występuje w różnych środowiskach, zarówno w wolnej przyrodzie, jak i na terenach zurbanizowanych. W Europie preferując jednak te ostatnie.
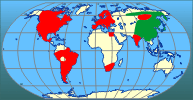
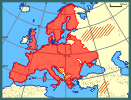
| | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Poza swój pierwotny areał H. axyridis została po raz pierwszy przeniesiona w 1916 roku do Stanów Zjednoczonych (Kalifornia), gdzie była sprzedawana jako drapieżnik zwalczający mszyce. Od tego czasu wielokrotnie sprowadzano ją do USA, gdzie w końcu wymknęła się spod kontroli i od 1988 r. jest obserwowana w różnych stanach, a także w Kanadzie. Jej pojaw odnotowano także w Ameryce Południowej (Meksyk, Argentyna, Brazylia, Peru, Chile), Afryce Północnej (Egipt) i Afryce Południowej, a spodziewany jest także na innych obszarach południowej półkuli (Poutsma i in. 2008). W Europie sprzedawano ją od 1995 r. we Francji, Belgii i Holandii, a jej występowanie w warunkach naturalnych zaobserwowano po raz pierwszy w 1999 r. w Niemczech. Mniej więcej od około 2002 r. ma miejsce coraz szybsza ekspansja tego gatunku na naszym kontynencie. Notowana jest na coraz to nowych obszarach, obejmując obecnie swoim zasięgiem większość krajów naszego kontynentu. Na wschód od naszych granic była notowana na Łotwie, Białorusi i Ukrainie. Ostatnio jej obecność stwierdzono w Serbii i Bułgarii (Brown i in. 2008; Soares i in. 2008; Tomov i in. 2009). Sądząc po pierwszych pojawach, do Polski gatunek ten przybył z zachodu kontynentu. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Po raz pierwszy została stwierdzona w Polsce w 2006 roku na dwóch stanowiskach na Nizinie Wielkopolsko-Kujawskiej. W latach następnych podawana była z kolejnych stanowisk: początkowo w zachodniej części Polski aż do linii Wisły, a następnie rownież z północno-wschodniej i wschodniej części kraju aż po Lublin (Przewoźny i in. 2007; Jadwiszczak 2008; Ruta i in. 2009; Jędryczkowski w druku; inf. własne). Biorąc pod uwagę tempo ekspansji, a także dużą ilość niepublikowanych obserwacji, podawanych na forach internetowych (np. www.entomo.pl/forum/) można przyjąć, że gatunek ten zasiedla obecnie całe terytorium naszego kraju. | | | | | | Występowanie na terenach chronionych | | Publikowane informacje o występowaniu biedronki azjatyckiej dotyczą przede wszystkim aglomeracji miejskich, zarówno zadrzewień parkowych, jak i budynków mieszkalnych. W chwili obecnej brak jest danych o jej występowaniu na terenach chronionych. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Jako wysoce skuteczny drapieżnik, redukujący populacje mszyc na różnych uprawach rolnych, biedronka azjatycka była wielokrotnie introdukowana zarówno do Ameryki Północnej jak i do Europy. W warunkach naturalnych może jednak odgrywać również negatywną rolę w lokalnych ekosystemach, zagrażając rodzimym gatunkom biedronek. Jak wskazują badania prowadzone m.in. w Ameryce Północnej, Wielkiej Brytanii i Belgii (Adriaens i in. 2008, Lucas i in. 2007, Mizell 2007, Pell i in. 2008, Ware i Majerus 2008) na opanowanych terenach H. axyridis staje się dominującym drapieżnikiem, a liczebność zajmujących tę samą niszę rodzimych gatunków spada. Poza wysoką płodnością i wygrywaniem konkurencji o pokarm, biedronka azjatycka, zwłaszcza w stadium larwalnym, jest też często drapieżnikiem jaj, larw i poczwarek innych mniejszych lub zbliżonych rozmiarami biedronek. W Europie biedronka azjatycka jedynie w przypadku zetknięcia się z największą naszą biedronką, oczatką Anatis ocellata (L.) z drapieżnika staje się z reguły ofiarą. Jest dzisiaj za wcześnie, aby jednoznacznie ocenić wpływ biedronki azjatyckiej na ekosystemy i faunę Polski. Wymaga to dopiero przeprowadzenia dokładnych badań tego problemu. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Tak jak inni przedstawiciele Coccinellidae biedronka azjatycka w chwilach zagrożenia wydziela z gruczołów obronnych (zlokalizowanych w stawach nóg) żółtą hemolimfę, która w zetknięciu ze skórą człowieka może powodować reakcje alergiczne takie jak astmę, wysypkę lub zapalenie spojówek. Do kontaktów z ludźmi dochodzi najczęściej w budynkach mieszkalnych, gdzie owady dorosłe mogą masowo pojawiać się jesienią w poszukiwaniu miejsc dogodnych do przezimowania. Przy usuwaniu ich z miejsc niepożądanych należy więc profilaktycznie unikać bezpośredniego zetknięcia z owadami, używając np. rękawiczek lub odkurzacza. W ogrodnictwie gatunek ten może niekiedy powodować straty, gdy w ramach diety uzupełniającej uszkadza latem i jesienią owoce, co obserwowano np. w winnicach. Owady dorosłe przegryzały tam skórkę winogron, wchodząc do wnętrza owocu.
Badania przeprowadzone zarówno w USA, jak i w Europie (np. Koyama i Majerus 2008; Shapiro-Ilan i Cottrell 2005), wykazały dużą odporność H. axyridis na patogeniczne bakterie, grzyby i nicienie, a także parazytoidy. Jako najbardziej skutecznego drapieżnika, ograniczającego liczebność biedronki azjatyckiej podaje się robotnice mrówek, niszczące jaja i atakujące jej larwy (Burgio i in. 2008). Badań takich nie prowadzono w Polsce, niemniej jednak można zakładać, że również w warunkach polskich siły oporu środowiska będą w przypadku tego gatunku mało skuteczne, a ewentualne zwalczanie nadmiernego pojawu biedronki azjatyckiej może napotkać duże trudności.
| | | | | | Prognoza | | Dotychczasowe obserwacje i doświadczenia innych krajów europejskich wskazują, że biedronka azjatycka również w Polsce będzie zwiększać swoją liczebność, pojawiając się w coraz to nowych środowiskach. O ile w agrocenozach gatunek ten może odgrywać pozytywną rolę jako bardzo skuteczny drapieżnik mszyc, o tyle jego wpływ na populacje innych biedronek, a więc na rodzimą bioróżnorodność będzie prawdopodobnie negatywny. Brak wrogów naturalnych, odporność na patogeny i wysoka rozrodczość mogą spowodować wypieranie innych krajowych gatunków Coccinellidae z zajmowanych przez nie nisz ekologicznych, a ewentualne ustalenie się równowagi między nimi i adaptacja H. axyridis w krajowej faunie mogą być trudne i potrwać wiele lat. W miarę wzrostu liczebności biedronki azjatyckiej w środowiskach zurbanizowanych można się też spodziewać wystąpienia wielu uciążliwości w relacjach z ludźmi, spowodowanych masowym pojawem osobników hibernujących w budynkach mieszkalnych. | | | | | | Literatura | | - Adriaens T., San Martin y Gomez G., Maes D. 2008. Invasion history, habitat preferences and phenology of the invasive ladybird Harmonia axyridis in Belgium. BioControl, 53: 69-88.
- Berkvens N., Bonte J., Berkvens D., Deforce K., Tirry L., De Clercq P. 2008. Pollen as an alternative food for Harmonia axyridis. BioControl, 53: 201-210.
- Brown P. M. J., Adriaens T., Bathon H., Cuppen J., Goldarazena A., Hägg T., Kenis M., Klausnitzer B. E. M., Kovař I., Loomans A. J. M., Majerus M. E. N., Nedved O., Pedersen J., Rabitsch W., Roy H. E., Ternois V., Zakharov I. A., Roy D. B. 2008. Harmonia axyridis in Europe: spread and distribution of a non-native coccinellid. BioControl, 53: 5-21.
- Burgio G., Lanzoni A., Accinelli G., Maini S. 2008. Estimation of mortality by entomophages on exotic Harmonia axyridis versus native Adalia bipunctata in semi-field conditions in northern Italy. BioControl, 53: 277-287.
- Jadwiszczak A. S. 2008. Biedronki "ninja" już w Olsztynie. Natura - Przyroda Warmii i Mazur, 3(11): 5.
- Jędryczkowski W. [w druku]. Ekologiczne uwarunkowania występowania chrząszczy drapieżnych (Coleoptera: Coccinellidae) w aglomeracji warszawskiej. [W:] K. H. Dyguś, Y. L. Mediokritsky (red.). Ekologiczne problemy XXI wieku. WSEiZ, Warszawa.
- Koch R. L. 2003. The multicolored Asian lady beetle, Harmonia axyridis: A review of its biology, uses in biological control, and non-target impacts. Journal of Insect Science, 32(3): 1-16.
- Koyama S., Majerus M. E. N. 2008. Interactions between the parasitoid wasp Dinocampus coccinellae and two species of coccinellid from Japan and Britain. BioControl, 53: 253-264.
- Lucas E., Vincent Ch., Labrie G., Chouinard G., Fournier F., Pelletier F., Bostanian N. J., Coderre D., Mignault M-P., Lafontaine P. 2007. The multicolored Asian ladybeetle Harmonia axyridis (Coleoptera: Coccinellidae) in Quebec agroecosystems ten years after its arrival. European Journal of Entomology, 104: 737-743.
- Mizell R. F. 2007. Impact of Harmonia axyridis (Coleoptera: Coccinellidae) on native arthropod predators in pecan and crape myrtle. Florida Entomologist, 90(3): 524-536.
- Pell J. K., Baverstock J., Roy H. E., Ware R. L., Majerus M. E. N. 2008. Intraguild predation involving Harmonia axyridis: a review of current knowledge and future perspectives. BioControl, 53: 147-168.
- Poutsma J., Loomans A. J. M., Aukema B., Heijerman T. 2008. Predicting the potential geographical distribution of the harlequin ladybird, Harmonia axyridis, using the CLIMEX model. BioControl, 53: 103-125.
- Przewoźny M., Barłożek T., Bunalski M. 2007. Harmonia axyridis (Pallas, 1773) (Coleoptera: Coccinellidae) new species of ladybird beetle for Polish fauna. Polskie Pismo Entomologiczne, 76: 177-182.
- Ruta R., Jałoszyński P., Konwerski S., Majewski T., Barłożek T. 2009. Biedronkowate (Coleoptera: Coccinellidae) Polski. Część 1. Nowe dane faunistyczne. Wiadomości Entomologiczne, 28(2): 91-112.
- Shapiro-Ilan D. I., Cottrell T. E. 2005. Susceptibility of lady beetles (Coleoptera: Coccinellidae) to entomopathogenic nematodes. Journal of Invertebrate Pathology, 89: 150-156.
- Soares A. O., Borges I., Borges P. A. V., Labrie G., Lucas E. 2008. Harmonia axyridis: What will stop the invader? BioControl, 53: 127-145.
- Tomov R., Trencheva K., Trenchev G., Kenis M. 2009. The multicolored invasive Asian ladybird Harmonia axyridis (Pallas, 1773) (Coleoptera: Coccinellidae) new to the fauna of Bulgaria. Acta Zoologica Bulgarica, 61(3): 307-311.
- Ware R. L., Majerus M. E. N. 2008. Intraguild predation of immature stages of British and Japanese coccinellids by the invasive ladybird Harmonia axyridis. BioControl, 53: 169-188.
| | | | | | Streszczenie | | Harmonia axyridis is a native species to eastern Asia. It was introduced first to North America and next to Europe as a very effective predator of aphids to control their populations. Everywhere it has got out of hand and its populations spread in the wild in both Americas and most European countries. In Poland it was found for the first time in 2006 in the Wielkopolska-Kujawy Lowland and in the subsequent years it was recorded from other localities.Now, one can assume that the species has colonized the whole territory of our country. It has been shown that H. axyridis is a dominant predator in the areas it has invaded, while native species, occupying the same ecological niche, decrease in numbers. In addition to its high fertility and ability to out-compete native species for food, H. axyridis, particularly at the larval stage, often preys upon eggs, larvae and pupae of other smaller or similar in size ladybirds. Haemolymph, released by an agitated harlequin ladybird from its defensive glands, when in contact with human skin, may cause allergic reactions, such as asthma, exanthema or conjunctivitis. People most often come in contact with H. axyridis in buildings where imagines may appear in masses in the autumn in search for suitable wintering places. Observations and experience from other European countries show that also in Poland H. axyridis will increase in numbers, appearing in new environments every now and again. In agrocoenoses this species can play a positive role as a very effective predator of aphids but its effect on the populations of other ladybirds and the same, on the native biodiversity is most probably negative. As the numbers of H. axyridis increase in urban environments, one may expect that it will be a serious nuisance to people. Because of the short time that has lapsed since the species appeared in Poland and the lack of more detailed studies on different aspects of its occurrence, it is for the present impossible to predict what will be the effect of H. axyridis on the ecosystems and fauna of Poland. | | | | | | Opracowanie | | Daniel Kubisz | | | | |
|