
Mnemiopsis leidyi L. Agassiz, 1865
Warty Comb Jelly |   | Rodzina | | Bolinopsidae | | Rząd | | Lobata | | Gromada | | Tentaculata ramieniowe | | Typ | | Ctenophora parzydełkowce | | |
 | |  | | | | | | | | |
 | | | | | | Locus typicus/Terra typica | | Stany Zjednoczone AP, stan Południowa Karolina, wybrzeże atlantyckie: miejsce Charleston Harbor - M. gardeni i M. mccradyi (L. Agassiz 1860, Mayer 1990); okolice Woods Hole - M. leidyi (A. Agassiz 1865). | | | | | | Pierwotna ojczyzna gatunku | | Z natury występuje wzdłuż atlantyckich wybrzeży Ameryki od 42° szer. geogr. północnej do 46° szer. geogr. południowej. | | | | | | Podstawowe cechy morfologiczne | | M. leidyi należy do żebropławów płatowych. Przedłużeniem ciała (korpusu) żebropława są płaty gębowe. Pod dwoma głównymi płatami gębowymi znajdują się cztery mniejsze płaty. W czasie swojego ruchu płaty zamykają całkowicie otwór gębowy. Płaty gębowe mają na obrzeżach wici. Środkowa część płatów gębowych znajduje się ponad wargami szczeliny gębowej. Obie wargi są wyjątkowo kurczliwe (Agassiz 1860, Seravin 1994), w środkowej części mają one wyraźny fałd który sięga do końcowej części kanału gardłowego. Dookoła zewnętrznego końca obu warg przebiegają cztery kanały utworzone z rozdwojonych dalszych końców kanału gardłowego (Fewkes 1881). Ponad wargami gębowymi znajduje się aparat czułkowy (tentacularny). Wzdłuż boków ciała kępki cienkich czułków tworzą specjalne bruzdy. Końce bruzd uchodzą do warg gębowych tworząc wyjątkowo efektywny aparat chwytny (Agassiz 1865, Seravin 1994). Zwierzę porusza się dzięki uderzeniom witek (czułków) pokrywających powierzchnię jego grzebieni. Pływa głównie otworem gębowym do przodu, skierowanym najczęściej do góry, czasem do dołu. Poruszanie się jest kontrolowane przez system nerwowy. Na biegunie apikalnym występuje statocysta. Podskórna sieć systemu nerwowego znajduje się głównie pod rzędami grzebieniastych łapek. M. leidyi jest samozapładniającym się obojnakiem. Gonady znajdują się wzdłuż ośmiu południkowych kanałów system gastro-waskularnego. Rzędy spermatoforów (jąder) są rozłożone wzdłuż kanałów południkowych. Rzędy jajników znajdują się naprzeciw (w sąsiadujących kanałach). Liczba wytwarzanych jednocześnie jaj zależy od dostępności pokarmu i temperatury.
M. leidyi jest wyraźnie fosforyzujący. Świecenie jest związane z rzędami grzebyków lokomocyjnych (wici ruchowych). Są one niezwykle wrażliwe. Delikatne potrząśnięcie naczyniem, w którym znajduje się zwierzę wystarcza do wyzwolenia wyraźnej reakcji świetlnej. Komórki produkujące światło znajdują się w kanałach południkowych, leżą asymetrycznie w stosunku do osi kanału.
Dosyć często, szczególnie w nowo zasiedlonych rejonach, spotykane są formy o pewnych różnicach w morfologii w stosunku do osobników typowych, najprawdopodobniej jest to związane z niekorzystnymi warunkami rozwoju (Shiganova 1998). | | | | | | Biologia, ekologia | | M. leidyi należy do makrozooplanktonu. Występuje w płytkich estuariach i zatokach atlantyckiego wybrzeża Ameryki, których głębokość to koło 2 do 30 metrów (Kremer 1994). Występuje także w bardziej otwartych wodach przybrzeżnych (Harbison i in. 1978, Purcell i in. 2001). Jest organizmem eurytermicznym. Temperatury, w których jest spotykany, wahają się w przedziale od 0°C w rejonach północnych zimą do 32°C w subtropikalnych estuariach latem. Zwykle największą liczebność gatunku obserwuje się przy temperaturze wody około 20°C (Kremer 1994, Purcell i in. 2001). Zaliczany jest do organizmów euryhalinowych. Zakres zasolenia, w którym gatunek występuje to 5 do 38 PSU (practical salinity unit = g/1 litr wody). Zasiedlane rejony charakteryzują się zwykle występowaniem dużej ilości zooplanktonu od 11 do 200 mg C m-3. Trzy czynniki mają istotny wpływ na liczebność M. leidyi. Są to w kolejności od najistotniejszego: temperatura, dostępność pokarmu i śmiertelność (drapieżnictwo - wyżeranie) (Kremer 1994). Od niezamierzonej introdukcji do Morza Czarnego rozprzestrzenił się do wód przyległych, zasiedlając wody o zasoleniu od 3 (Morze Azowskie, najprawdopodobniej coroczne nowe kolonizacje) do 39 PSU (wschodnia część Morza Śródziemnego), przy temperaturach wody od 4°C zimą do 31°C latem (Shiganowa i in. 2001). Znosi bardzo niską zawartość tlenu w wodzie do 0,2-0,3 mg dm-3 (Purcel i in. 2001).
Przenoszony jest przez prądy morskie. Nie stwierdzono wędrówek dobowych, chociaż nocą M. leidyi są liczebniejsze przy powierzchni, gdzie żerują i rozmnażają się. Zwykle występują ponad termokliną, chociaż duże osobniki mogą być spotykane w wodach głębszych.
Jak większość żebropławów M. leidyi jest jednoczesnym obojnakiem z możliwością samozapłodnienia, dlatego całe pokolenie może pochodzić od jednego osobnika (Planka 1974, Hirota 1972, Reeve i Walter 1976). Może rozmnażać się na długo przedtem, zanim osiągnie swoje maksymalne rozmiary. Stwierdzono u niego również przypadki pedogenezy (dojrzałości płciowej larw i osobników młodocianych), a także dojrzałości płciowej larw z następującą po niej regresją gonad, a następnie powtórną dojrzałością płciową osobników dorosłych (Planka 1974).
Rozwój gonad i ich aktualny stan wykazują wyraźny dzienny rytm. Rozród rozpoczyna się późnym wieczorem, z największym natężeniem o północy lub o godzinie pierwszej, drugiej w nocy (Freeman i Reynolds 1973, Zaika i Revkov 1994).
Jaja pęcznieją w ciągu jednej minuty od kontaktu z morską wodą. Płodność uzależniona jest od wielkości ciała. Duże osobniki produkują od 2 do 8 tysięcy jaj w czasie rozrodu. Największe potrafią wyprodukować od 10 do 14 tysięcy jaj (Baker i Reeve 1974, Kremer 1975). Żebropławy mogą zacząć produkować jaja 13 dni po wykluciu, mając 26 mm długości. W Morzu Czarnym jaja produkują już osobniki o długości 15 mm, a zdarza się nawet, że 12 mm, ważące 0,5 g (Shiganova i in. 2001).
M. leidyi jest mięsożerny. Połyka wszystkie organizmy, jakie jest w stanie schwytać płatami gębowymi, wliczając w to holoplankton, planktonowe larwy organizmów bentosowych, jaja i larwy ryb (Nelson 1925, Main 1928, Tzikhon-Lukanina i in.1993). Fitoplankton czasem znajdowany w żołądkach najprawdopodobniej pochodzi ze strawionych widłonogów (Hirota 1974). Skład pokarmu zmienia się w zależności od sezonu, miejsca i pory dnia. W lecie są to głównie planktonowe skorupiaki: małe osobniki preferują wioślarki, a większe widłonogi oraz jaja i larwy ryb (Tzikhon-Lukanina i in. 1991a, 1991b, 1992). Średnia wielkość pokarmu zawiera się w przedziale 0,75-1 mm. Żebropławy bytujące w wodach przybrzeżnych mają bardziej urozmaicony pokarm w porównaniu z bytującymi w wodach otwartych (Tzikhon-Lukanina i in. 1991a). Zawiera on więcej widłonogów, larw ryb i larw bezkręgowców (w grupie tej zwykle dominują larwy mięczaków).
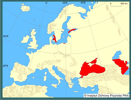
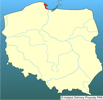
Pokarm jest chwytany przy pomocy płatów i czułków. Zwierzę aktywnie poszukuje pokarmu, pływając z otworem gębowym skierowanym do przodu. Prędkość przemieszczania się żebropława jest zmienna w zależności od jego wielkości i stanu fizjologicznego. Maksymalna prędkość "marszowa" żerującego żebropława waha się pomiędzy 0,2 a 1,2 cm × s-1 (Larson 1988). Trawienie pokarmu trwa do 1 do 3 godzin w zależności do wielkości zdobyczy (Harbison i in. 1978, Reeve i Walter 1978). Żebropław kontynuuje chwytanie zdobyczy nawet gdy żołądek jest pełny, wypluwając niestrawione resztki planktonu sklejone galaretowatą wydzieliną. Dorosłe M. leidyi regenerują uszkodzone fragment ciała (Coonfield 1936). Organizm odbudowuje się, gdy jest podzielony na połowę, na trzy lub cztery części. Najpierw regenerowany był organ biegunowy (szczytowy), następnie rzędy płytek i płytki w tych rzędach. Regeneracja płytek następowała w ciągu trzech dni po odtworzeniu rzędów. Wydaje się, że narząd szczytowy żebropława jest centrum regulującym regeneracją. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Zawleczenie M. leidyi z któregoś rejonu Ameryki do Europy nastąpiło w latach 80. XX wieku. Prawdopodobnie dostał się tu w wodach balastowych statków. Pierwsze inwazją zostało dotknięte Morze Czarne, a później także Azowskie i Kaspijskie. Gatunek ten przedostał się także do Morza Marmara i Egejskiego. W Bałtyku po raz pierwszy stwierdzono obecność M. leidyi w Zatoce Kilońskiej w 2006 roku (Hansson 2006, Javidpour i in. 2006). W 2007 roku notowany był u wybrzeży Finlandii i Szwecji (Kube i in. 2007, Lehtiniemi i in. 2007), a na początku października tego roku po raz pierwszy stwierdzono jego obecność w polskich wodach Bałtyku, w Zatoce Gdańskiej. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Po raz pierwszy stwierdzono występowanie M. leydyi w Zatoce Puckiej w październiku 2007 (Janas i Zgrundo 2007). W ciągu kilku następnych tygodni, żebropław ten był obserwowany w dosyć dużych ilościach w różnych miejscach zachodniej części Zatoki Gdańskiej. | | | | | | Występowanie na terenach chronionych | | Prawie cała zachodnia część Zatoki Gdańskiej, gdzie występuje ten gatunek, włączona jest w system ochrony Natura 2000. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Ze względu na bardzo niedawne pojawienie się M. leidyi w Bałtyku nie można na razie mówić o udokumentowanym wpływie na ekosystem i gatunki rodzime.
Wpływ masowej obecności M. leidyi na ekosystem naszych wód jest na razie trudny do przewidzenia, choć może być bardzo groźny. Jeśli nowi przybysze zaczną masowo zjadać zooplankton, a pelagiczna ikra oraz larwy ryb staną się także obiektem polowań żebropławów, to możemy się spodziewać wyraźnego zmniejszenia wielkości zasobów ryb użytkowych, przede wszystkim szprota i śledzia. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Zawleczenie M. leidyi do Morza Czarnego stało się przyczyną bardzo daleko idących zmian w ekosystemie tego morza. Jego masowy rozwój w Morzu Czarnym i Azowskim był główną przyczyną znacznego ograniczenia liczebności kilku ważnych dla rybołówstwa gatunków ryb (Shiganova 1997, 1998, Shiganova i in. 2001a, 2001b). Straty poniesione z tego tytułu wyniosły w latach 90. ubiegłego wieku ok. 300 milionów dolarów. W przypadku masowego pojawienia się w Bałtyku, ten odżywiający się planktonem i larwami ryb organizm może być przyczyną poważnych zmian w strukturze sieci troficznej i daleko idącego zagrożenia dla funkcjonowania rybołówstwa, szczególnie śledziowego i szprotowego. W Morzu Czarnym swego rodzaju "lekarstwem" na inwazję było zawleczenie innego żebropława Beroe ovata, który jest drapieżnikiem odżywiającym się prawie wyłącznie żebropławami. Obecnie rozważa się możliwość wsiedlenia tego gatunku również do zaatakowanego przez M. leidyi Morza Kaspijskiego (Shiganova i in. 2001a). W Bałtyku, z pominięciem bardzo dużego ryzyka i niepewności końcowych efektów przy tego rodzaju manipulacjach, takie działanie jest niemożliwe ze względu na najprawdopodobniej zbyt niskie dla B. ovata zasolenie. | | | | | | Prognoza | | Trudno obecnie przewidzieć, jakie będą dalsze losy M. leidyi w Bałtyku. Żebropław ten jest gatunkiem polimorficznym o dużej tolerancji w stosunku do wielu czynników środowiskowych. Temperatura i zasolenie wód Bałtyku nie są barierą dla jego rozmnażania. Nie ma tu również naturalnych wrogów, odżywiających się tym gatunkiem. Na obecnym etapie inwazji trudno jest jednak ocenić czy nowy gatunek pozostanie jedynie ciekawostką przyrodniczą, czy też spowoduje daleko idące zmiany w funkcjonowaniu bałtyckiego ekosystemu. Nie można także wykluczyć, że będzie pojawiał się coraz rzadziej i w końcu przestanie być notowany w naszych wodach. Dotychczasowy przebieg pojawiania się M. leidyi w Bałtyku wydaje się jednak wskazywać na stopniowe powiększanie się liczebności i obszaru zasiedlanego przez ten gatunek. | | | | | | Literatura | | - Agassiz A. 1865. North American Acalephae. Illustrated catalog of the Museum of Comparative Zoology 2: 1-234 (Boston).
- Agassiz L. 1860. Contribution of the natural history of the United States of America. Truber and Co Boston 3: 1-321.
- Baker J. D., Reeve M. R. 1974. Laboratory culture of lobate ctenophore Mnemiopsis mccradyi with notes on feeding and fecundity. Marine Biology 31, 1: 61-100.
- Coonfield B. R.1936. Regeneration in Mnemiopsis leidyi, Agassiz. Biological Bulletin 71: 421-428.
- Fewkes J. W. 1881. Studies of the jelly-fish of Narraganset Bay. Bulletin of Museum of Comparative Zoology Vol. 8: 141-182.
- Freeman G., Reynolds G. T. 1973. The development of bioluminescence in the ctenophore Mnemiopsis leidyi. Development Biology 31, 1: 61-100.
- Hansson H. G. 2006. Ctenophores of the Baltic and adjacent Seas - the invader Mnemiopsis is here! Aquatic Invasions 1(4): 295-298.
- Harbison G. R., Madin L. P., Swanberg N. R. 1978. On the natural history and distribution of oceanic ctenophores. Deep-Sea Research 25: 233-256.
- Hirota J. 1972. Laboratory culture and metabolism of the ctenophore Pleurabrachia bachei A. Agassiz. In: Takenouti A. Y. et al. (eds), Biological oceanography of the northern North Pacific Ocean. Idemitsu Shoten: 465-484.
- Hirota J. 1974. Quantitative natural history of Pleurobrachia bachei in La Jolla Bight. Fishery Bulletin 72: 295-335.
- Janas U., Zgrundo A. 2007. First records of Mnemiopsis leidyi A. Agassiz, 1865 in the Gulf of Gdansk (southern Baltic Sea). Aquatic Invasions 2(4): 450-454.
- Javidpour J., Sommer U., Shiganova T. 2006. First record of Mnemiopsis leidyi A. Agassiz, 1865 in the Baltic Sea. Aquatic Invasions 1 (4): 299-302.
- Kremer P. M. 1975. The ecology of the ctenophore, Mnemiopsis leidyi in Narragansett Bay. Ph.D. Dissertation, University of Rhode Island.
- Kremer P.M. 1994. Patterns of abundance for Mnemiopsis in US coastal waters: a comparative overview. ICES Journal of Marine Sciences 51: 347-354.
- Kube S., Postel L., Honnef C., Augustin C.B. 2007. Mnemiopsis leidyi in the Baltic Sea - distribution and overwintering between autumn 2006 and spring 2007. Aquatic Invasions 2 (2): 137-145.
- Larson R. J. 1988. Feeding and Functional Morphology of the Lobate Ctenophore Mnemiopsis mccradyi. Estuarine, Coastal and Shelf Science 27: 495-502.
- Lehtiniemi M., Pääkkönen J.-P., Flinkman J., Katajisto T., Gorokhova E., Karjalainen M., Viitasalo S., Björk H. 2007. Distribution and abundance of the American comb jelly (Mnemiopsis leidyi) - A rapid invasion to the northern Baltic Sea during 2007. Aquatic Invasions 4 (2): 445-449.
- Main R. J. 1928. Feeding mechanism of Mnemiopsis. Biologial Bulletin 55: 69-78.
- Mayer A. G. 1990. Description of new and little-known medusae from Western Atlantic. Bulletin of Museum of Comparative Zoology 37: 1-12.
- Nelson Th. C. 1925. On the occurrence and food habitat of ctenophores in New Jersey Island coastal waters. Biological Bulletin 48: 92-111.
- Planka H. D. 1974. Ctenophora. In: Glese A. C. Pearse J. S. (eds). Reproduction of marine invertebrates 1: 201-265.
- Purcell J. E., Shiganova T. A., Decker M. B. Houde E. D. 2001. The ctenophore Mnemiopsis leidyi in native and exotic habitats: U. S. estuaries versus the Black Sea basin. Hydrobiologia 451: 145-176.
- Reeve H., Walter M. A. 1976. A large-scale experiment on the growth and predation potential of ctenophore populations. In: G. Mackie (ed.). Coelenterate ecology and behavior. Plenum: 187-199.
- Seravin L. N. 1994. The systematic revision of the genus Mnemiopsis (Ctenophora, Lobata). Zoologitcheskij Zhurnal 73: 9-18.
- Shiganova T. A., 1998. Invasion of the Black Sea by the ctenophore Mnemiopsis leidyi and recent changes in pelagic community structure. In: Coombs S. (ed.). Fisheries Oceanography - GLOBEC Special Issue, 7: 305-310.
- Shiganova T. A. 1997. Mnemiopsis leidyi abundance in the Black Sea and its impact on the pelagic community. In Ozsoy E., Mikaelyan A. (eds), Sensitivity of North Sea, Baltic Sea and Black Sea to Antropogenic and Climatic Changes. Kluwer Academic Publishers, Dordrecht-Boston-London: 117-130.
- Shiganova T. A. Kamakin A. M., Ushivtzev V. B., Zhukova O. 2001a. New Invasion of ctenophore Mnemiopsis in the Caspian Sea. Oceanology 41, 4: 542-549.
- Shiganova T. A., Mirzoyan Z. A., Studenikina E. A., Volovik S. P., Siokoi-Frangou I., Zervoudaki S., Christou E. D., Skirta A. Y., Dumont H. 2001b. Population development of the invader ctenophore Mnemiopsis leidyi in the Black Sea and other seas of the Mediterranean basin. Marine Biology 139: 431-445.
- Tzikhon-Lukanina E. A., Reznichenko O. G. 1991a. Feeding peculiarities of different size speciments of ctenophore Mnemiopsis in the Black Sea. Oceanology 31: 442-446.
- Tzikhon-Lukanina E. A., Reznichenko O. G., Lukasheva T. A. 1991b. Quantitative aspects of feeding in the Black Sea ctenophore Mnemiopsis leidyi. Oceanology 31: 272-276.
- Tzikhon-Lukanina E. A., Reznichenko O. G., Lukasheva T. A. 1992. What ctenophore Mnemiopsis eats in the Black Sea inshore waters? Oceanology 32: 724-729.
- Tzikhon-Lukanina E. A., Reznichenko O. G., Lukasheva T. A. 1993. Predation rates on fish larvae by the ctenophore Mnemiopsis leidyi in the Black Sea inshore waters. Oceanology 33: 895-899.
| | | | | | Streszczenie | | The native habitat of Mnemiopsis leidyi includes estuaries and coastal regions along the eastern coast of North and South America, from around 42°N to around 46°S. It was originally described from Charleston Harbor, South Carolina. After the genus revision, all three described species M. mccradyi, M. leidyi and M. gardeni are treated as one and the same species, i.e. M. leidyi.
Warty Comb Jelly is a generalist feeder; it preys on fish eggs and larvae, different kinds of smaller holoplanktonic animals, and pelagic larvae of different benthic invertebrates. In areas with dense populations of this ctenophore, it may affect local populations of species with late summer or autumn larvae.
The species is polymorphic because of its environmental adaptability. Its very high reproduction rate, hermaphroditism and very high body regeneration abilities allow Warty Comb Jelly to establish into different environmental conditions in the southern Eurasian seas.
Warty comb jelly was introduced into the Black Sea in the 1980s. It showed an explosive mass development there since 1988 and expanded to the Azov, Marmara, and eastern Mediterranean seas and in 1999 it was introduced into the Caspian Sea most probably with ballast water of oil tankers. M. leidyi strongly affected all levels of ecosystems and fishery in the productive Black, Azov and Caspian waters; however no remarkable effect were recorded in the oligotrophic Aegean Sea.
In the Black Sea the introduction had at first severe consequences, especially for the anchovy and European and Caspian kilka fishery. After the introduction of the predatory ctenophore Beroe ovata which also originates from the American Atlantic waters, the situation has changed.
The main factors controlling M. leidyi population are temperature and prey availability.
In the Baltic Sea M. leidyi was noticed for the first time in the Kiel Bight in 2006. In 2007, it was noted on Finland and Swedish coasts and at the beginning of October of that year in the Gulf of Gdańsk.
Two pathways could have brought M. leidyi into the Baltic Sea. First, it could have been brought with ballast water from America or the Black Sea region. Second, M. leidyi could have been transferred into the Baltic Sea with the currents from the North Sea, where M. leidyi was observed earlier. It is unknown if the M. leidyi population is able to survive winter in the Baltic Sea. Anyway, each year it may be brought anew into the Baltic Sea with the currents from the North Sea.
In the coming years we have to be very observant regarding the new invader. Currently, it is difficult to predict the future role of M. leidyi in the Baltic Sea. | | | | | | Opracowanie | | Mariusz M. Sapota | | | | |
|