
Sinanodonta woodiana (Lea, 1834)
szczeżuja chińska
Chinese Huge Mussel |   | Rodzina | | Unionidae skójkowate | | Rząd | | Eulamellibranchia blaszkoskrzelne | | Gromada | | Bivalvia małże | | Typ | | Mollusca mięczaki | | |
 | |  | | | | | | | | |
 | | | | | | Pierwotna ojczyzna gatunku | | Azja Wschodnia: Daleki Wschód - dorzecze Amuru i Jangcy. | | | | | | Podstawowe cechy morfologiczne | | Muszla w zarysie owalna lub kolisto-owalna, duża, o długości 12-20 cm, charakteryzująca się dużą zmiennością. Różnorodność kształtu i barwy muszli determinują czynniki środowiskowe, głównie charakter podłoża, intensywność przepływu wody i temperatura (Kraszewski 2003, 2005). Wierzchołki muszli są przesunięte ku przodowi, w części środkowej silnie uwypuklone, brzeg grzbietowy wznosi się za wierzchołkiem ku górze, skrzydełko jest wyraźnie zaznaczone. Muszle osobników młodocianych są cienkościenne i delikatne, natomiast starszych są grubościenne i masywne z wyraźnie zaznaczonymi liniami przyrostów rocznych. Ubarwienie muszli jest zróżnicowane - od ciemnobrunatnego przez brunatny lub miodowy do zielonooliwkowego. Po wewnętrznej stronie muszli mogą się tworzyć liczne różnokształtne inkrustacje, nacieki i półperły.
U Sinanodonta woodiana brak jest wyraźnego dymorfizmu płciowego, choć niekiedy muszle samic są nieco bardziej wypukłe niż muszle samców. Na podstawie pomiarów małży z systemu podgrzanych jezior i kanałów konińskich wykazano, iż długość muszli zwiększa się wraz ze wzrostem temperatury wody (Kraszewski i Zdanowski 2001, Kraszewski 2003). W najchłodniejszych strefach systemu dominowały osobniki o długości muszli 70-115 mm, w umiarkowanie podgrzanych - 90-125 mm, a w najcieplejszych - 125-160 mm. Największe okazy miały powyżej 200 mm długości. Większe osobniki tego gatunku, o długości 270 mm (Girardi i Ledoux 1989), 266 mm (Djajasasmita 1982) i 251 mm (Kiss 1995) stwierdzono we Francji, na Jawie i na Węgrzech. | | | | | | Biologia, ekologia | | Gatunek rozdzielnopłciowy; przebieg cyklu rozwojowego Sinanodonta woodiana jest zbliżony do cyklu innych przedstawicieli rodziny Unionidae i determinowany licznymi czynnikami środowiskowymi, m.in. temperaturą, dynamiką mas wodnych czy aktywnością ryb (Dudgeon i Morton 1983). Samce i samice osiągają dojrzałość płciową przy długości muszli około 30-40 mm. Dojrzewanie gamet następuje już od wczesnej wiosny. Gonady wypełniają się wówczas dojrzałymi jajami lub plemnikami; komórki jajowe przenoszone są do komór lęgowych w zewnętrznych płatach skrzeli, a plemniki wydostają się do wody, skąd niesione jej prądem dostają się do skrzeli, gdzie dochodzi do zapłodnienia. Z zapłodnionych jaj rozwija się ektoparazytalna larwa zwana glochidium. Wyrzut glochidiów ze skrzeli małży do wody zachodzi najczęściej od wiosny do połowy lata, choć jest również możliwy w okresach chłodniejszych. Glochidia wbijają się w ciało ryb, głównie w płetwy (zwłaszcza piersiowe i ogonowe) i w skrzela, gdzie przebywają przez kilkanaście dni. Kiss (1995) określił ten czas na 220-250 stopnio-dni, co w warunkach węgierskich wyniosło 8-12 dób, natomiast w podgrzanych wodach jezior konińskich - 4-9 dób (A. Kraszewski - dane niepubl). Jansen (1991) stwierdził, że w przypadku innego gatunku szczeżui, w warunkach naturalnych na rybach może występować kilkanaście do kilkudziesięciu larw. Po przeobrażeniu młode małże opadają na dno i zagrzebują się na znaczną głębokość w osady denne, gdzie przebywają do momentu uzyskania dojrzałości płciowej, kiedy to przemieszczają się do ich warstw powierzchniowych. Dorosłe małże zagłębiają się przednią częścią muszli w osadach, na ogół do 1/3, czasem do połowy jej długości, z syfonami skierowanymi ku górze w kierunku przeciwnym do kierunku przepływu wody. Dojrzałe małże zasiedlają najchętniej strefę przybrzeżną, już od głębokości kilkudziesięciu centymetrów do głębokości kilku metrów w systemie podgrzanych jezior i kanałów konińskich były to z reguły głębokości od 1,5 do 3,5 m (Kraszewski 2003). Zasiedlanie płytszej strefy przybrzeżnej jezior konińskich ograniczała duża amplituda wahań poziomu wody (ok. 1 m). Zdaniem Widuto (1968) spadek poziomu wody w tempie większym niż 2,5 cm na godzinę można uznać za wartość graniczną. Małże z rodziny Unionidae nie są wtedy zdolne opuścić odsłanianej strefy dna. O wyborze miejsc bytowania decyduje charakter dna i prędkość przepływu, czynnikami ograniczającymi są kamienie, elementy zabudowy hydrotechnicznej oraz zwarte pasy makrofitów (Kraszewski 2003). Małże występują w środowiskach lotycznych i lenitycznych, unikają stref zastoiskowych, zbyt silnej turbulencji wody oraz gruboziarnistego podłoża; preferują miejsca o umiarkowanej prędkości przepływu i wyższej temperaturze wody, gdzie na ogół grupują się w ławice. Niekiedy zagęszczenie w takich miejscach przekracza 60 osobn./m2 , a biomasa sięga wówczas nawet 25 kg/m2, przeważnie wynosi jednak od kilku do kilkunastu osobników na metr kwadratowy. Szczeżuje chińskie zaliczane są do jednych z najbardziej efektywnych filtratorów; z badań Kissa (1995) wynika, że w ciągu godziny jeden małż może przefiltrować około 1-2 litrów wody. Zjadają one cząstki pokarmu już o średnicy od kilku mikrometrów, głównie glony, detrytus oraz drobny zooplankton. Obserwacje Kraszewskiego (2003) wykazały, że małże najszybciej rosły w środowiskach o wyższej temperaturze i latem - najszybciej rosły osobniki jednoroczne i dwuletnie. Struktura wiekowa konińskiej populacji Sinanodonta woodiana jest zbliżona do struktury wiekowej populacji rodzimych gatunków skójkowatych, występujących w naturalnych ekosystemach (Lewandowski i Stańczykowska 1975, Lewandowski 1976, 1990; Dusoge i in. 1999, Abraszewska-Kowalczyk 2002). Szczeżuje chińskie osiągały wiek 6-9 lat, a najliczniejszą grupę (ok. 70% populacji) stanowiły osobniki 3-5-letnie (Kraszewski 2003). Struktura płciowa w populacjach Unionidae zależna jest od warunków środowiska, w którym żyją małże i może odbiegać od najbardziej typowego modelu 1:1, a hermafrodytyzm i jego modyfikacja są zjawiskiem naturalnym (Tudorancea 1972, Heard 1975, Bauer 1987). Dominacja osobników żeńskich, obecność form hermafrodytycznych oraz grupowanie się małży w zwarte ławice zwiększają sukces reprodukcyjny i stanowią skuteczną strategię rozrodczą. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Gatunek rozprzestrzenił się poza naturalny obszar występowania na skutek działań wiązanych z hodowlą ryb. Odnotowano jego obecność w Azji Południowej (Kambodża, Tajwan, Tajlandia, Malezja, Japonia, Hong Kong) i w Ameryce (Dominikana, Kostaryka) (Žadin 1952, Djajasasmita 1982, Dudgeon i Morton 1983, Gomez i in. 1986, Fukuhara i Nagata 1995, Watters 1997).
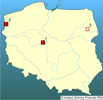
Do ekosystemów wodnych Europy zawleczony został na początku lat 60. XX wieku do Rumunii, a w latach 1963-65 do stawów hodowlanych w Szarvas na Węgrzech (Kiss 1995) wraz z introdukowanymi chińskimi rybami roślinożernymi: tołpygą białą Hypophthalamichthys molitrix (Valenciennes, 1844), tołpygą pstrą Aristichthus nobilis (Richardson, 1836), amurem białym Ctenopharyngodon idella (Valenciennes, 1844) i amurem czarnym Mylopharyngodon piceus (Richardson, 1846). Od kilkunastu lat tworzy stabilne populacje w Dunaju, Cisie i Kereszu (Kiss i Pekli 1988; Kiss i Petro 1992, Kiss 1995). Spotykany był także w Jugosławii, na Ukrainie, w Słowacji, w Czechach, Niemczech, Austrii i Francji (Petro 1984, Sárkány-Kiss 1986, Girardi i Ledoux 1989, Falkner 1990, Guelmino 1991, Kiss i Petro 1992, Reichholf i Steinbach 1992, Košel 1995, Beran 1997, Reichling 1999, Jurišinec i Kornjušin 2001). Według Wattersa (1997) małż ten mógł zasiedlać również stawy w okolicach Moskwy. Ryby pochodzące stamtąd miały bowiem na płetwach glochidia tych małży. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Małż ten został zawleczony z Węgier z narybkiem ryb roślinożernych w połowie lat 80. XX wieku i od tego czasu zasiedla system podgrzanych jezior i kanałów konińskich (Protasov i in. 1993, Afanasjev i in. 1996, Zdanowski i in. 1996, Kraszewski i Zdanowski 2001, Afanasjev i in. 2001). Ponadto znaleziono kilka muszli tych małży w rzece Narwi (Bőhme 1998). W roku 2002 znaleziono S. woodiana w stawach rybnych na terenie Sierakowskiego Parku Krajobrazowego (Wielkopolska), dokąd została zawleczone prawdopodobnie z narybkiem karpia 5 lat wcześniej (Mizera i Urbańska 2003). Jesienią 2003 roku obecność tych małży stwierdzono 50 km od Szczecina, w Nowym Czarnowie, w kanale zrzutu wód podgrzanych, Zespołu Elektrowni Dolna Odra (Domagała i in. 2004). W latach 2004-2005 odnaleziono S. woodiana w kanałach Międzyodrza, w wodach o naturalnym reżimie termicznym, zamarzających na zimę (Domagała i in. 2007). | | | | | | Występowanie na terenach chronionych | | Stwierdzony na terenie Sierakowskiego Parku Krajobrazowego i Zespołu Parków Krajobrazowych Doliny Dolnej Odry. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | W związku z preferencją szczeżui chińskiej do wyższych temperatur prawdopodobnie nie będzie stanowić ona większego zagrożenia dla rodzimych gatunków skójkowatych, z którymi ewentualnie mogłaby konkurować o siedlisko. W systemie jezior i kanałów konińskich rodzime gatunki Unionidae preferują chłodniejsze strefy lotyczne i lenityczne, podczas gdy szczeżuje chińskie najlepiej rozwijały się w temperaturze nie przekraczającej latem 30°C, a zimą nie niższej niż 10°C. Szczeżuje chińskie nie wpływają bezpośrednio negatywnie na rodzimą faunę, choć istnieje hipotetyczna możliwość przeniesienia pasożytów specyficznych dla tego gatunku, a mogących być zagrożeniem dla innych małży. Konieczny jest jednak okresowy monitoring tego gatunku, gdyż jego etologia nie jest do końca poznana. Należy zachować szczególną ostrożność i ograniczyć niekontrolowane wsiedlanie obcych małży do krajowych ekosystemów, gdyż konsekwencje ich oddziaływania są na razie trudne do przewidzenia. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Dotychczasowe obserwacje i badania nie wskazują na to, aby ten obcy dla polskiej malakofauny gatunek był przyczyną istotnych zmian w środowisku. Nie stanowi też zagrożenia dla różnorodności biologicznej środowisk wodnych Polski. Nie wykazuje w pełni cech typowego gatunku inwazyjnego. Jest stosunkowo ekspansywny, a jego populacja może osiągnąć w krótkim czasie wysoką liczebność i biomasę, co zaobserwowano w środowisku półnaturalnym, jakim jest system podgrzanych jezior i kanałów konińskich. | | | | | | Prognoza | | Małż ten wymaga do rozwoju wysokiej temperatury wody (10-35°C), toteż w wodach naturalnym reżimie termicznym rozwój i rozprzestrzenianie się jego populacji są utrudnione. Przykładem jest nieudane zawleczenie Sinanodonta woodiana do Narwi niedaleko wsi Topilec, choć z drugiej strony istnieją dane o dwóch już obszarach o naturalnej termice wód, zasiedlonych niedawno przez ten gatunek. W naszych szerokościach geograficznych jednak głównie wody podgrzane stwarzają szanse przeżycia przez szczeżuję chińską okresów jesienno-zimowych. Zatem ekspansja tego gatunku, poza systemami wód podgrzanych, włączonych w obieg chłodzenia elektrowni i ewentualnie innych zakładów przemysłowych, wydaje się mieć również w przyszłości tylko ograniczony charakter. | | | | | | Literatura | | - Abraszewska-Kowalczyk A. 2002. Unionid bivalves of the Pilica river catchement area. Folia Malacologica 10 (3): 99-173.
- Afanasjev C.A., Protasov A., Zdanowski B., Tunowski J. 1996. Osobennosti raspredelenija dvustvorčatych molljuskov v sistemie podogretych koninskich ozer. Gidrobiologičeskij Žurnal 32 (3): 33-44.
- Afanasjev S.A., Zdanowski B., Kraszewski A. 2001. Growth and population structure of the mussel Anodonta woodiana (Lea, 1834) (Bivalvia, Unionidae) in the heated Konin lakes system. Archives of Polish Fisheries 9 (1): 123-131.
- Bauer G. 1987. Reproductive strategy of the freshwater pearl mussel Margaritifera margaritifera. Journal of Animal Ecology 56: 691-704.
- Beran L. 1997. First record of Sinanodonta woodiana (Mollusca: Bivalvia) in the Czech Republic. Acta Societas Zoologicae Bohemicae 61 (1): 1-2.
- Bőhme M. 1998. Ein neuer Fundort der Chinesichen Teichmuschel (Sinanodonta woodiana) in Mitteleuropa. Heldia 2 (5/6): 166.
- Djajasasmita M. 1982. The occurenece of Anodonta woodiana Lea 1834 in Indonesia (Pelecypoda: Unionidae). Veliger 25: 175.
- Domagała J., Migdalska B., Łabęcka A.M., Pilecka-Rapacz M. 2004. Anodonta woodiana (Lea, 1834) na Pomorzu Zachodnim. Zeszyty Naukowe Uniwersytetu Szczecińskiego. Acta Biologica 10: 199-202.
- Domagała J., Łabęcka A.M., Migdalska B., Pilecka-Rapacz M. 2007. Colonisation of the channels of Międzyodrze (northwestern Poland) by Sinanodonta woodiana (Lea, 1834) (Bivalvia: Unionidae). Polish Journal of Natural Sciences 22 (4): 679-690.
- Dudgeon D., Morton B. 1983. The population dynamics and sexual strategy of Anodonta woodiana (Bivalvia, Unionacea) in Plover Cove Reservoir, Hong Kong. Journal of Zoology (London) 201: 161-183.
- Dusoge K., Lewandowski K.B., Stańczykowska A. 1999 Benthos of various habitats in the Zegrzyński Reservoir (central Poland). Acta Hydrobiologica 41: 103-113.
- Falkner G. 1990. Binnenmollusken. In: Fechter R., Falkner G. (eds) Weichtiere. Europäische Meeres- und Binnenmollusken. Steinbachs Naturfűhrer, Mosaik Verlag Műnchen, 10: 112-280.
- Fukuhara S., Nagata Y. 1995 Estimation of the factors determining the intervals among individuals of the freshwater mussel Anodonta woodiana Lea (Bivalvia: Unionidae) in small pond. Venus 54 (4): 317-327.
- Girardi H. Ledoux J.-C. 1989. Présence d' Anodonta woodiana (Lea) en France (Mollusques, Lamellibranches, Unionidae). Bulletin Mensuel de la Société Linnéenne de Lyon 58 (9): 286-291.
- Gomez J.D., Vargas M., Malek E.A. 1986. Freshwater mollusks of the Dominican Republic. Nautilius 100 (4): 130-134.
- Guelmino J. 1991. Anodonta woodiana woodiana Lea, 1834 (Mollusca: Bivalvia) prvi nalaz u donjem toku Tise. Matica Srpska Prestampans iz zbiornika matice srpske za prirodne. Nauke Broj: 80.
- Heard W.H. 1975. Sexuality and other aspects of reproduction in Anodonta (Pelecypoda: Unionidae). Malacologia 15: 81-103.
- Jansen W.A. 1991. Seasonal prevalence, intensity of infestation, and distribution of glochidia of Anodonta grandis simpsoniana Lea on yellow perch, Perca flavescens. Canadian Journal of Zoology 69: 964-972.
- Jurišinec V.I., Kornjušin A.V. 2001. Novyj dla fauny Ukrainy vid dvustvorčatych molljuskov Sinanodonta woodiana (Bivalvia: Unionidae), diagnostika i vozmožnyje puti introdukcii. Vestnik Zoologii 35 (1): 79-84.
- Kiss A. 1995. The propagation, growth and biomass of the chinese huge mussel (Anodonta woodiana woodiana 1834) in Hungary. University of Agricultural Sciences of Godollo. Hungary. Privat Edition, Second Ed.: 1-33.
- Kiss A., Pekli J. 1988. On the growth rate of Anodonta woodiana woodiana (Lea 1834), (Bivalvia: Unionacea). Bulletin of Agricultural Sciences 1: 119-124.
- Kiss A., Petro E. 1992. Distribution and biomass of some chinese-mussel (Anodonta woodiana woodiana Lea, 1834) (Bivalvia: Unionicea) population in Hungary. Abstracts of the XII International Malacological Congress in Siena, Unitas Malacologica: 31-33.
- Košel V. 1995. The first record of Anodonta woodiana (Mollusca, Bivalvia) in Slovakia. Acta Zoologica Universitatis Comeniensis, Bratislava 39: 3-7.
- Kraszewski A. 2003. Struktura i funkcjonowanie populacji małży chińskich Sinanodonta woodiana (Lea, 1834) w systemie podgrzanych jezior konińskich. Praca doktorska. Wydział Ochrony Środowiska i Rybactwa UWM w Olsztynie, maszynopis: 1-116.
- Kraszewski A. 2008 (w druku). Biomorphological variation in the Chinese clam Sinanodonta woodiana (Lea, 1834) in the heterogeneous conditions of the Konin heated lake system in central Poland. Folia Malacologica.
- Kraszewski A., Zdanowski B. 2001. The distribution and abundance of the chinese mussel Anodonta woodiana (Lea, 1834) in the heated Konin lakes. Archives of Polish Fisheries 9 (2): 253-265.
- Lewandowski K. 1976. Unionidae as a substratum for Dreissena polymorpha (Pall). Polskie Archiwum Hydrobiologii 23: 409-420.
- Lewandowski K. 1990. Unionidae of Szeszupa river and of the lakes along its course in Suwalski Landscape Park. Ekologia Polska 38 (3-4): 271-286.
- Lewandowski K., Stańczykowska A. 1975. The occurrence and role of bivalves of the family Unionidae in Mikołajskie Lake. Ekologia Polska 23 (2): 317-334.
- Mizera T., Urbańska M. 2003. A record of Anodonta woodiana (Lea) from the Sierakowski Landscape Park. In: Pokryszko B. (ed.) The 19-th Polish Malacological Seminar. Folia Malacologica 11 (3/4): 103-114.
- Petro E. 1984. The occurance and presence of Anodonta woodiana woodiana (Lea 1834) in Hungary. Állatani Közlemények, LXXI, 84: 189-191.
- Protasov A. A., Afanasjev S. A., Zdanowski B. 1993. Naturalne systemy samooczyszczania wód jezior konińskich. Komunikaty Rybackie 6: 6-9.
- Reichholf J.H., Steinbach G. 1992. Naturenzyklopädie Europas. Mollusken und andere Wirbellose. Mosaik Verlag, 6: 319.
- Reichling H.J. 1999. Erstnachweis der Chinesischen Teichmuschel Sinanodonta woodiana in Deutschland. NABU Märkischer Kreisverband, Infoheft 24-32.
- Sárkány-Kiss A. 1986. Anodonta woodiana (Lea, 1834) a new species in Romania (Bivalvia: Unionicea). Travaux du Muséum d'Histoire Naturelle "Grigore Antipa" Bucarest 28: 15-17.
- Tudorancea C. 1972. Studies on the Unionidae populations from the Crapina - Jijila complex of pools (Danube zone diable to inundation). Hydrobiologia 39: 527-561.
- Watters T. 1997. A synthesis and review of the expanding range of the Asian freshwater mussel Anodonta woodiana (Lea, 1834) (Bivalvia: Unionidae). Veliger 40 (2): 152-156.
- Widuto J. 1968. Zachowanie się małżów z rodziny Unionidae przy obniżaniu poziomu wody w zbiornikach. Zeszyty Naukowe WSR w Olsztynie 24 (642): 499-508.
- Zdanowski B. 1996. Nieznana szczeżuja (Anodonta sp. ) w podgrzanych jeziorach konińskich. XII Krajowe Seminarium Malakologiczne, Łódź, 25-27.04.1996: 43.
- Žadin V.I. 1952. Molljuski presnych i solonovatych vod SSSR. Akademia Nauk SSSR. Moskva - Leningrad, 1-376.
| | | | | | Streszczenie | | It is a mussel originating from the Far East, from the drainage basins of the Amur and Jangcy rivers. It has been widely distributed in South Asia, America and Europe due to fish farming. At the beginning of the 1960s it was introduced to Romania and Hungary with China herbivorous fishes. It was brought to Poland from Hungary in the mid 1980s, with the fry of these fishes, and since then it has inhabited the system of heated Konin lakes and canals. In 2004 the presence of S. woodiana was noted in a cooling water discharge canal of the "Dolna Odra" power station in Nowy Czarnów. Shells of Chinese Huge Mussel were found also in the Narew River. These mussels colonize most willingly the littoral zone, from a depth of several dozen centimeters to a few meters; in the Konin lakes and canals usually from 1.5 to 3.5 m. They occur in lotic and lentic habitats but avoid both stagnating waters and strong water turbulence. Limiting factors are also stones, coarse-grained substratum, elements of hydrotechnical constructions and dense patches of macrophytes. Chinese Huge Mussels often form aggregations whose densities may exceed 60 ind./m2 (and biomass may amount to 25 kg/m2), but usually are between a few to ten-twenty ind.//-m2. There are no data indicating that S. woodaina could cause significant changes in the environment or be a threat to biological diversity of water habitats in Poland. The species does not pose any danger to native mussels because of its temperature requirements: it is able to develop only in high temperature (10-35°C), inhabiting only heated reservoirs and waterways. There is, however, a risk of infection of native mussels with specific parasites carried by Chinese Huge Mussel. | | | | | | Opracowanie | | Andrzej Kraszewski i Bogusław Zdanowski | | | | |
|