
Marenzelleria neglecta Sikorski & Bick 2004
|   | Rodzina | | Spionidae | | Rząd | | Spionida | | Gromada | | Polychaeta wieloszczety | | Typ | | Annelida pierścienice | | |
 | |  | | | | | | | | |
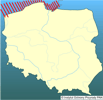 | | | | | | Locus typicus/Terra typica | | Południowy Bałtyk (Sikorski i Bick 2004); gatunek opisany poza naturalnym zasięgiem, w miejscu introdukcji. | | | | | | Pierwotna ojczyzna gatunku | | Atlantyckie estuaria Ameryki Północnej, wody wzdłuż wybrzeży Ameryki Północnej od Nowej Funlandii do stanu Georgia, jakkolwiek stwierdzony też w przybrzeżnych północnoamerykańskich wodach Pacyfiku i w wodach Arktyki (Sikorski i Bick 2004). | | | | | | Podstawowe cechy morfologiczne | | Wieloszczet o długości do 115 mm i szerokości do 2 mm, zbudowany maksymalnie z 250 segmentów. Prostomium w kształcie dzwonu, zaokrąglone z przodu, często wcięte pośrodku. Dwie pary plamek ocznych, leżących na linii lub formujących trapez, z tylną parą położoną bliżej siebie, czułki krótkie, nigdy nie sięgające poza 10 segment. W zależności od rozmiaru od 1 (u osobników młodocianych) do 69 par skrzeli. Na pygidium występuje od czterech (osobniki młodociane) do 7 par (osobniki dorosłe) analnych wąsów. Osobniki pozbawione pigmentu, czasami z małymi czarnymi punktami na czułkach (Sikorski i Bick 2004). | | | | | | Biologia, ekologia | | Długość życia osobników określa się na 3 lata. Rozwój gamet rozpoczyna się w maju, a osiągnięcie dojrzałości płciowej osobników następuje po około 20 tygodniach. Samica produkuje od 30-40 tys. jaj. M. neglecta ma larwy pelagiczne, najliczniej występujące w planktonie przybrzeżnych wód Bałtyku, we wrześniu i październiku. Po trwającym około miesiąca okresie życia pelagicznego, dno kolonizowane jest przez bardzo liczne osobniki (do 250 000 osobn./m2) młodych stadiów bentosowych (Bochert i Bick 1995, Bochert i in. 1996, Bochert 1997, Zettler i in. 1995, Zettler 1996, 1997 a, b). M. neglecta - podobnie jak wszystkie wieloszczety z rodziny Spionidae - pobiera pokarm w przejściowej strefie pomiędzy osadami a wodą, przy pomocy pary czułków. Dostępność pokarmu nie jest ściśle związana z określonym typem osadów, ponieważ osobniki mogą pobierać zarówno cząstki pokarmowe zawieszone w toni wodnej, jak i materiał zdeponowany na powierzchni osadów (selektywny detrytofag) (Hempel 1957, Fauchland i Jumars 1979, Dauer i in. 1981). Jest typowym gatunkiem słonawowodnym, preferującym zasolenie wody od 0,5 do 10 psu, bardzo dobrze adaptującym się w wodach zeutrofizowanych, przeważających wśród zbiorników słonawowodnych (Schiedek 1997, Sikorski i Bick 2004). Zasiedla zarówno osady piaszczyste, jak i muliste, budując skomplikowany system rozgałęzionych kanalików (rurek). Osobniki mogą penetrować osady nawet do głębokości 30-35 cm (Zettler i in. 1994, 1995, 2003; Kube i in. 1996a, b; Żmudziński 1996, Ezhova i Spirido 2005). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | W wodach europejskich występowanie przedstawicieli Marenzelleria opisano po raz pierwszy na początku lat 80. XX wieku na podstawie materiałów z estuariów Morza Północnego (Essink i Kleef 1988, Mc Lusky i in. 1993). Prawdopodobne jest znacznie wcześniejsze, nieudokumentowane występowanie tego rodzaju w M. Północnym (Bick i Burckhardt 1989). Spotykane osobniki oznaczano początkowo jako M. vireni, a następnie jako M. viridis. W Bałtyku pierwsze osobniki stwierdzono w niemieckiej części Zalewu Szczecińskiego w 1985 roku (Bick i Burckhardt 1989). Populacje z Morza Północnego i Morza Bałtyckiego różniły się zarówno morfologicznie (Bick i Zettler 1997), jak i okresem rozmnażania (Bochert i in. 1996) i zaczęto je opisywać jako M. cf. wireni w Morzu Północnym i M. cf. viridis w Morzu Bałtyckim. Porównawcze badania genetyczne wskazywały również na istnienie dwu różnych gatunków (Bastrop i in. 1995,1997,1998; Röhner i in.1996 a, b). Rewizja rodzaju Marenzelleria (Sikorski i Bick 2004) wykazała, że w Bałtyku żyje tylko jeden gatunek, Marenzelleria neglecta, opisywana wcześniej jako M. cf. viridis. Osobniki tego gatunku zostały prawdopodobnie zawleczone do Bałtyku w wodach balastowych statku. Na bezpośrednią introdukcję gatunku do Morza Bałtyckiego wskazuje jego brak w europejskiej części Atlantyku i Morzu Północnym, do którego introdukowana została M. wireni (Sikorski i Bick 2004). Biorąc pod uwagę wyjątkowo dużą tolerancję tego gatunku na niekorzystne warunki środowiskowe, szanse przeżycia larw bądź osobników dorosłych, w zbiornikach balastowych statków są bardzo duże (Essink i Kleef 1988, Kube i in. 1996a, Fritsche 1997, Kube i Powilleit 1997, Gruszka 1999, Zettler i in. 2003). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | W polskich wodach osobniki z rodzaju Marenzelleria po raz pierwszy stwierdzono w 1986 roku w północnej części Zalewu Szczecińskiego, a w 1988 roku w rejonie Zatoki Pomorskiej (Gruszka 1991, 1999; Masłowski 1992) i Zatoki Gdańskiej (Warzocha i Gostkowska1996) oraz w Zalewie Wiślanym (Żmudziński i in. 1996, Żmudziński 1996). Wielka produkcja larw oraz mobilność starszych stadiów larwalnych i stadiów bentosowych, które potrafią pływać, jest prawdopodobnym wyjaśnieniem tak szybkiej ekspansji wzdłuż polskich wybrzeży Bałtyku. W ciągu kilku lat M. neglecta rozpowszechniła się na całym obszarze strefy przybrzeżnej polskiego Bałtyku oraz w zalewach. W rejonach przyujściowych Odry i Wisły oraz w Zalewie Wiślanym należy do gatunków dominujących, stanowiąc od kilku do kilkudziesięciu procent całkowitej biomasy makrozoobentosu (Żmudziński 1996, Kube i in 1996b, Ezhova i in. 2005, Warzocha i in. 2005). | | | | | | Występowanie na terenach chronionych | | M. neglecta zasiedla wszystkie siedliska chronione w polskich wodach morskich i zalewach przymorskich, w ramach sieci obszarów chronionych NATURA 2000. Zasiedla również przybrzeżne wody morskie włączone do Słowińskiego i Wolińskiego Parku Narodowego. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Ze względu na biologię i ekologię M. neglecta jest potencjalnym konkurentem pokarmowym zarówno filtratorów (np. małże Mytilus edulis, Mya arenaria, jak i detrytofagów (np. Nereis diversicolor). Jednak dotychczasowe badania, w większości przypadków, nie wykazały istotnego, negatywnego wpływu na inne bezkręgowce denne (np. Zettler 1996, Kotta i Kotta 1998). Może to wynikać z niewielkiej różnorodności fauny w słonawym i stosunkowo młodym zbiorniku, jakim jest Morze Bałtyckie. Zagrzebując się głębiej niż większość rodzimych gatunków i zwiększając tym samym głębokość bioturbacji, M. neglecta może również pozytywnie oddziaływać na inne organizmy poprzez dostarczanie substancji biogenicznych i tlenu do osadów (np. Zettler 1996, Olenin i Leppäkoski 1999). Trudno jest jeszcze ocenić znaczenie M. neglecta w odżywianiu ryb. Winkler i Debus (1996) stwierdzili występowanie tego wieloszczeta w pokarmie kilkunastu gatunków ryb, poczynając od 1987 roku. Ryby planktonożerne (np. śledź) zjadały stadia larwalne, podczas gdy stadia bentosowe stwierdzone zostały np. u płastug i okonia. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Nie ma dowodów na istotnie szkodliwy wpływ tego gatunku w polskich wodach. Zwalczanie gatunków inwazyjnych w morzu jest, w jakimś stopniu, realne tylko w formie zapobiegania niezamierzonej introdukcji gatunków obcych (np. wymiana wód balastowych przy przekraczaniu stref zoogeograficznych). | | | | | | Prognoza | | M. neglecta opanowała już cały obszar Morza Bałtyckiego oraz zalewów przymorskich po Wyspy Alandzkie, Zatokę Fińską i Zatokę Ryską oraz Zatokę Botnicką (Essink 1999, Zettler i in. 2003). W zachodniej części Bałtyku, która została zasiedlona najwcześniej, po okresie intensywnego rozwoju nastąpił okres stabilizacji, a następnie zdecydowany spadek liczebności (Zettler i in. 2003). Również w Zalewie Wiślanym w latach 1997-2004 obserwowano stabilizację liczebności (Ezhova i Spirido 2005, Ezhova i in. 2005). W polskiej strefie Bałtyku, w wodach przybrzeżnych, liczebność tego gatunku ustabilizowała się po kilku latach dynamicznego rozwoju. Obecnie, w Głębi Bornholmskiej i Zatoce Gdańskiej obserwuje się natomiast zasiedlanie przez M. neglecta dna głębszego (do głębokości około 60-75 m), gdzie niekorzystne warunki tlenowe ograniczają występowanie innych, mniej tolerancyjnych gatunków (Warzocha i in. 2005, dane niepubl.). Można więc sądzić, że - podobnie jak w przypadku innych gatunków, które przywędrowały do Bałtyku w różnych okresach jego rozwoju - populacja M. neglecta ustabilizuje się na poziomie nie zagrażającym środowisku przyrodniczemu akwenu bałtyckiego. | | | | | | Literatura | | - Bastrop R., Röner M., Jürss K. 1995. Are there two species of the polychaete genus Marenzelleria in Europe?. Marine Biology 121: 509-516.
- Bastrop R., Röhner M., Sturmbauer C., Jürss K. 1997. Where did Marenzelleria spp. (Polychaeta: Spionidae) in Europe come from?. Aquatic Ecology 31 (2):119-136.
- Bastrop R., Sturmbauer C., Jürss K. 1998. Cryptic species in a marine polychaete and their independent introducion from North America to Europe. Molecular Biology and Evolution 15 (2): 97-103.
- Bick A., Burckhardt R. 1989. Erstnachweis von Marenzelleria viridis (Polychaeta,
- Spionidae) für den Ostseeraum, mit einem Bestimmungsschlüssel der Spioniden der Ostsee. Mitteilungen aus den Zoologischen Museum in Berlin 65: 237-247.
- Bick A., Zettler M.L. 1997. On the identity and distribution of two species of Marenzelleria (Polychaeta, Spionidae) in Europe and North America. Aquatic Ecology 31 (2): 137-148.
- Bochert R., Bick A. 1995. Reproduction and larval development of Marenzelleria viridis (Polychaeta: Spionidae). Marine Biology 123: 763-773.
- Bochert R., Fritsche D., Burckhardt R. 1996. Influence of salinity and temperature on growth and survival of the planctonic larvae of Marenzelleria viridis (Polychaete, Spionidae). Journal of Plankton Research 18 (7): 1239-1251.
- Bochert R. 1997. Marenzelleria viridis (Polychaeta: Spionidae): a review of it's reproduction. Aquatic Ecology 31 (2): 137-148.
- Dauer D.M., Maybury C.A., Ewing R.M. 1981. Feeding behavior and general ecology of several spionid polychaetes from the Chesapeake Bay. Journal of Experimental Marine Biology and Ecology 54: 21-38.
- Essink K. 1999. Dispersal and development of Marenzelleria spp. (Polychaeta, Spionidae) populations in NW Europe and the Netherlands. Helgoländer Meeresuntersuchungen 52: 367-372.
- Essink K., Kleef H.L. 1988. Marenzelleria viridis (Verrill, 1873) (Polychaeta: Spionidae): a new record from the Ems Estuary (The Netherlands/Federal Republik of Germany). Zoologische Bijdragen (Leiden) 38: 1-13.
- Ezhova E., Żmudziński L., Maciejewska K. 2005. Long-term trends in the macrozoobenthos of the Vistula Lagoon, southeastern Baltic Sea. Species composition and biomass distribution. Bulletin of the Sea Fisheries Institute in Gdynia 1 (164): 55-73.
- Ezhova E., Spirido O. 2005. Patterns of spatial and temporal distribution of the Marenzelleria cf. viridis population in the lagoon and marine environment in the southeastern Baltic Sea. Oceanological and Hydrobiological Studies vol. XXXIV, Supplement 1: 209-226.
- Fauchland K., Jumars P.A. 1979. The diet of worms: a study of polychaete feeding guilds. Oceanography and Marine Biology an Annual Revue 17: 193-284.
- Fritsche D. 1997. Marenzelleria cf. viridis: Responses to salinity change and low oxygen pressure - A summary of information from resistance experiments and calorimetry. Rostocker Meeresbiologische Beiträge 5: 103-117.
- Gruszka P. 1991. Marenzelleria viridis (Verril, 1873) (Polychaeta-Spionidae) - a new component of shallow water benthic community in the Southern Baltic. Acta Ichtiologica et Piscatoria vol. XXI, suppl.: 57-65.
- Gruszka P.1999. The river Odra estuary as a gateway for alien species immigration to the Baltic Sea Basin. Acta Hydrochimica and Hydrobiologica 27 (5): 374-382.
- Hempel C. 1957. Über den Röhrenbau und die Nahrungsaufnahme einiger Spioniden (Polychaeta, Sedentaria) der deutschen Küsten. Helgoländer Wissenschaftlichen Meeresuntersuchungen 51: 399-416.
- Kotta J., Kotta I. 1998. Distribution and invasion ecology of Marenzelleria viridis in the Estonian coastal waters. Proceedings of the Estonian Academy of Sciences Biology Ecology 47 (3): 212-220.
- Kube J., Zettler M. L., Gosselck F., Ossig S., Powilleit M. 1996a. Distribution of Marenzelleria viridis (Polychaeta:Spionidae) in the southwestern Baltic Sea in 1993/94 - 10 years after introduction. Sarsia 81: 131-142.
- Kube J., Powilleit M., Warzocha J. 1996b. The importance of hydrodynamic processes and food availability for the structure of macrofauna assemblages in the Pomeranian Bay (Southern Baltic). Archive für Hydrobiology 138: 213-228.
- Kube J., Powilleit M. 1997. Factors controlling the distribution of Marenzelleria cf. viridis, Pygospio elegans and Streblospio shrubsoli (Polychaeta: Spionidae) in the southern Baltic Sea, with special attention for the response to an event of hypoxia. Aquatic Ecology 31: 187-198
- Masłowski J. 1992. Bottom macrofauna of the Szczecin Lagoon (north-western Poland). Acta
- Hydrobiologia 34: 253-274.
- McLusky D.S., Hull S.C., Elliot M. 1993. Variations in the intertidal and subtidal macrofauna and sediments along a salinity gradient in the upper Forth Estuary. Netherland Journal of Aquatic Ecology 27: 101-109.
- Olenin S., Leppäkoski E. 1999. Non-native animals in the Baltic Sea: alternation of benthic habitats in coastal inlets and lagoons. Hydrobiologia 393: 233-243.
- Röhner M., Bastrop R., Jürss K. 1996a. Genetic differences between two allopatric populations (or sibling species?) of the polychaete genus Marenzelleria in Europe. Comparative Biochemistry and Physiology 114 B: 181-192.
- Röhner M., Bastrop R., Jürss K. 1996b. Colonization of Europe by two American genetic types or species of the genus Marenzelleria (Polychaeta: Spionidae). An electrophoretic analysis of allozymes. Marine Biology 127: 277-287.
- Schiedek D. 1997. Marenzelleria cf. viridis (Polychaeta: Spionidae) - ecophysiological adaptations to a life in the coastal waters of the Baltic Sea. Aquatic Ecology 31: 199-210.
- Sikorski A.V., Bick A. 2004. Revision of Marenzelleria Mesnil, 1896 (Spionidae, Polychaeta), Sarsia 89: 253-275.
- Warzocha J., Gostkowska J. 1996. Macrofauna communities in the Gdańsk Basin: spatial and temporal variability. Proceedings of the 13th Symposium of the Baltic Marine Biologists: 131-136.
- Warzocha J., Gromisz S., Woźniczka A., Koper M. 2005. Distribution of Marenzelleria viridis (Polychaeta: Spionidae) along the Polish coast of the Baltic Sea. Oceanological and Hydrobiological Studies vol. XXXIV, Supplement 1: 227-237.
- Winkler H.M., Debus L. 1996. Is the polychaete Marenzelleria viridis an important food item for fish?. Proceedings of the 13th Symposium of the Baltic Marine Biologists: 147-151.
- Zettler M.L., Bochert R., Bick A. 1994. Röhrenbau und Verteilung von Marenzelleria viridis (Polychaeta: Spionidae) in einem inneren Küstengewässer der südlischen Ostsee. Rostocker Meeresbiologische Beiträge 2: 215-225.
- Zettler M.L., Bick A., Bochert R. 1995. Distribution and population dynamics of Marenzelleria viridis (Polychaeta: Spionidae) in a coastal water of the southern Baltic. Archive of Fishery and Marine Research 42: 209-224.
- Zettler M.L.1996. Successful establishment of the spionid polychaete, Marenzelleria viridis (Verrill, 1873), in the Darss-Zingst estuary (southern Baltic) and its influence on the indigenous macrozoobenthos. Archive of Fishery and Marine Research 43 (3): 273-284.
- Zettler M.L. 1997a. Population dynamics, growth and production of the neozoon Marenzelleria viridis (Verrill, 1873) (Polychaeta: Spionidae) in a coastal water of the southern Baltic Sea. Aquatic Ecology 31: 177-186.
- Zettler M.L. 1997b. Larval settlement behaviour and habitat selection of a new established spionid polychaete Marenzelleria viridis (Verrill, 1873): field and laboratory experiments. Rostocker Meeresbiologische Beiträge 5: 139-155.
- Zettler M.L., Daunys D., Kotta J., Bick A. 2003. History and success of an ivasion into theBaltic Sea: the polychaete Marenzelleria cf. viridis, development and strategies. W: Leppäkoski, Gollasch, Olenin (eds) Invasive Aquatic Species of Europe: 66-75.
- Żmudziński L. 1996. The effect of the introduction of the American species Marenzelleria viridis (Polychaeta: Spionidae) on the benthic ecosystem of Vistula Lagoon. P.S.Z.N.I: Marine Ecology 17 (1-3): 221-226.
- Żmudziński L., Chubarova-Solovjeva S., Dobrowolski Z., Gruszka P., Olenin S., Wolnomiejski N. 1996. Expansion of the spionid polychaete Marenzelleria viridis in the southern part of the Baltic Sea. Proceedings of the 13th Baltic Marine Biologists Symposium, Jurmala, Latvia 1993: 127-129.
| | | | | | Streszczenie | | Spionid polychaetes of the genus Marenzelleria were first recorded in European waters in early 1980s in North Sea estuaries. In the Baltic Sea area, the first Marenzelleria individuals were found in 1985 in the Szczecin Lagoon, and the first record of it in the polish waters dates to 1988. In 2004 specimens of genus Marenzelleria from the Baltic Sea were described as Marenzelleria neglecta Sikorski and Bick sp.nov. The estuaries of North America are belived to be the most likely area of origin, and transportation in vessel balast waters the most plausible explanation of arriving in Europe. Marenzelleria neglecta is regarded as a typical brackish water species occurring in both inshore areas and coastal lagoons, within a wide range of environmental conditions. The polychaete has become, very rapidly, a dominant species in many coastal areas of the Baltic Sea. In the southwestern Baltic, the highest abundances were recorded at salinities of 5 and 8 PSU, especially in the bays with high concentration of phytoplankton. The available data from the Polish Baltic waters does not reveal any significant impact on the autochtonous benthic community. | | | | | | Opracowanie | | Jan Warzocha | | | | |
|