
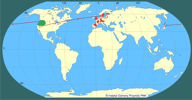
Pacifastacus leniusculus (Dana, 1852)
rak sygnałowy, rak kalifornijski
Signal Crayfish, Pacific Crayfish, Californian Crayfish |   | Rodzina | | Astacidae rakowate | | Rząd | | Decapoda dziesięcionogi | | Gromada | | Crustacea/Malacostraca pancerzowce | | Typ | | Arthropoda stawonogi | | |
 | |  | | | | | | | | |
 | | | | | | Locus typicus/Terra typica | | Rzeka Columbia oraz Cieśnina Puget w stanie Washington, Stany Zjednoczone - Pacifastacus leniusculus leniusculus (Dana 1852).
Dwa dalsze podgatunki opisano na podstawie osobników z dolnego odcinka rzeki Columbia poniżej miasta Astoria w stanie Oregon - P. l. trowbridgii (Stimpson, 1857) oraz z Jeziora Klamath w stanie Oregon - P. l. klamathensis (Dana, 1852). | | | | | | Pierwotna ojczyzna gatunku | | Za obszar naturalnego występowania gatunku uznaje się północno-zachodnie Stany Zjednoczone - stany Washington, Oregon, Idaho, zachodnie tereny stanów Montana (Sheldon 1989) i Wyoming (Lewis 2002), północne obszary stanów Kalifornia, Nevada i Utah oraz południową część Kolumbii Brytyjskiej w Kanadzie (Mason 1977). | | | | | | Podstawowe cechy morfologiczne | | Budowa typowa dla raków słodkowodnych. Długość ciała zwykle do 16 cm, lecz mogą występować osobniki większe, zwłaszcza samce, ważące ponad 200 g. Głowotułów twardy, gładki bez jakichkolwiek kolców czy guzków. Ostro zakończone rostrum ma gładkie, nieząbkowane żeberko środkowe. Boki rostrum równoległe. Za każdym okiem para listew zaocznych pierwsza para wydłużona, zakończona ostrym kolcem druga krótsza, często tylko w postaci lekko wydłużonego guzka. Szczypce duże, masywne, u samców zewnętrzna krawędź nieruchomego palca szczypców (propus) charakterystycznie łukowato wygięta. Szczypce w zasadzie gładkie, choć ich powierzchnia usiana bardzo drobnymi wgłębieniami (dołeczkami) jest bardziej matowa niż powierzchnia głowotułowia. Wewnętrzne krawędzie zamkniętych szczypiec nieprzylegające do siebie. Na wewnętrznej krawędzi nieruchomego palca szczypców dwa wyraźnie widoczne guzki rozstawione mniej więcej w 1/4 i 3/4 jej długości, pomiędzy nimi wyraźne łukowate wykrojenie krawędzi wewnętrznej. Na wewnętrznej krawędzi kciuka (ruchomy palec, dactylus) jeden guzek mniej więcej w 1/3 jej długości. Boki odwłoka pozbawione kolców. Gonopodium samców bez wyrostka zwanego talonem (P. Śmietana - dane niepubl.).
Barwa strony grzbietowej zmienna, od ciemnozielonej przez brązową do ciemnobrunatnej, najczęściej z wiśniowym odcieniem. Barwa strony brzusznej szarobiała do ciemnoszarej. Spodnia część szczypiec od jaskrawoczerwonej do ciemnopurpurowej, wyraźnie różniąca się kolorem od reszty brzusznej części ciała. Na zgrubieniu stawu u nasady kciuka szczypiec jasna, często biała plama, szczególnie widoczna na wierzchniej stronie szczypiec (Mastyński i Andrzejewski 2001). | | | | | | Biologia, ekologia | | Gatunek ten występuje w różnego typu zbiornikach i ciekach wodnych, od dużych jezior po stawy oraz od małych strumyków po wielkie rzeki. Preferuje miejsca o twardym dnie, zwłaszcza takim, które umożliwia znalezienie gotowych kryjówek lub kopanie nor. Ta ostatnia cecha behawioralna zwierzęcia może stwarzać zagrożenie dla trwałości ziemnych umocnień i barier hydrotechnicznych (Holdich 2000). Toleruje zasolenie wody do 21‰ (Holdich i in. 1997) oraz temperaturę wody do 33°C (Rutledge i Pritchard 1981). Wykazuje silną skłonność do migracji i kolonizacji nowych obszarów. Potrafi pokonywać przeszkody omijając je drogą lądową. Dojrzałość płciową może osiągać już w drugim roku życia (1+) (Abrahamsson 1971). Okres parzenia się w wodach polskich zaczyna się z końcem września, składanie jaj w październiku, czyli co najmniej trzy tygodnie wcześniej niż u rodzimego raka szlachetnego Astacus astacus czy raka błotnego A. leptodactylus. Samica może składać ponad 540 jaj (McGriff 1983); płodność jest dodatnio skorelowana z wiekiem i wielkością samicy. Termin wylęgu, w zależności od temperatury wody, następuje od marca do lipca, w Polsce zwykle od końca maja do połowy czerwca. Żywi się bardzo zróżnicowanym pokarmem pochodzenia roślinnego i zwierzęcego (Momot i in. 1978). Tempo wzrostu wyraźnie szybsze niż raka szlachetnego (Śmietana i Krzywosz 2004). Długowieczny, może żyć - podobnie jak rodzimy rak szlachetny - do 20 lat.
W Polsce naturalnymi wrogami raka sygnałowego są okoń Perca fluviatilis, czapla Ardea cinerea, wydra Lutra lutra i norka amerykańska Mustela vison. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Rak sygnałowy, jako jeden z największych raków słodkowodnych Ameryki Północnej, głównie ze względów użytkowych był obiektem wielu introdukcji poza obszarem naturalnego występowania. Z jednego z wcześniejszych doniesień dowiadujemy się, że od roku1895 do 1916 dokonano przeniesienia tego gatunku ze wschodu Stanów Zjednoczonych do jeziora Tahoe we wschodniej Kalifornii na granicy z Nevadą. Przeprowadzoną tam i w rejonie Zatoki San Francisco introdukcję tego gatunku uważa się za główną przyczynę całkowitego wyginięcia endemicznego gatunku raka Pacifastacus nigrescens (Bouchard 1977). Podobnie, w wyniku konkurencji i wypierania przez raka sygnałowego, zagrożony jest inny endemiczny gatunek amerykański Pacifastacus fortis (Daniels 1980). W latach 90. XX w. silnie rozprzestrzeniony w zachodnich stanach USA rak sygnałowy był eksploatowany wraz z innym gatunkiem, Procambarus clarkii, na poziomie 300-500 ton rocznie (Huner 1994). Wprowadzany zaś w latach 1926-1930 do wód japońskich zaaklimatyzował się w nich i przyczynił do ograniczenia zasięgu występowania rodzimego raka Cambaroides japonicus (Kawai i Hiruta 1999).
W 1959 roku podjęto decyzję o wprowadzeniu raka sygnałowego do jeziora w południowej Szwecji. Równocześnie z rakiem sygnałowym sprowadzono tam w 1960 r. również innego amerykańskiego raka - Orconectes virilis. Z tych dwu gatunków zaaklimatyzował się tylko rak sygnałowy, tworząc stabilną populację (Śmietana i Strużyński 1996). Motywem tych introdukcji była próba znalezienia gatunku raka słodkowodnego, który byłby w stanie "zastąpić" w Szwecji raka szlachetnego, wyniszczonego w około 95% przez "dżumę raczą". Odporność północnoamerykańskich raków na tę epidemiczną chorobę (wywoływaną przez grzyb Aphanomyces astaci) zdecydowała o ich wyborze i sprowadzeniu do kraju, w którym raki odgrywały wyjątkową rolę w kulturze i tradycji społecznej, w tym także kulinarnej (Swahn 2004).
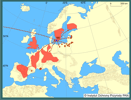
O udanym wprowadzeniu raka sygnałowego do wód Szwecji, a później również innych krajów Europy, zadecydowało dodatkowe sprowadzenie w 1969 r. 60 tysięcy osobników tego gatunku z jeziora Tahoe w Kalifornii. Rakami tymi zasiedlono 69 szwedzkich jezior (Brinck 1983). Założono też ośrodek hodowli raka sygnałowego Akvatiska Avelslaboratorium w Simontorp w południowej Szwecji. Ośrodek ten, po zaimportowaniu kolejnych 50000 osobników z jeziora Tahoe, już w sezonie 1970-1971 "wyprodukował" pierwsze 200 tysięcy młodocianych raczków, które użyte zostały do celów introdukcyjnych. Ośrodek w Simontorp, bazując na własnym materiale reprodukcyjnym, wyhodował do dziś ponad 20 milionów młodych osobników. Raki te rozprowadzono do co najmniej 2700 stanowisk na terenie Szwecji oraz dokonano introdukcji do wód 20 innych krajów, w tym Polski. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Podobnie jak w Szwecji, celem sprowadzenia raka sygnałowego do Polski było uzyskanie ekonomicznych korzyści wynikających z rybackiego użytkowania wód, w tym przypadku sprzedaży raków.
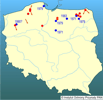
Introdukcję do Polski rozpoczęto w 1971 roku. Rok później zespół profesora Józefa Kossakowskiego z Instytutu Rybactwa Śródlądowego w Olsztynie sprowadził ze Szwecji z ośrodka Simontorp pierwszą partię 1000 osobników (Kossakowski 1983, Kossakowski i in. 1983, Krzywosz 1994). Do roku 1977 sprowadzono stamtąd łącznie 29 tysięcy osobników, z których 25 100 wpuszczono do mezotroficznego Jeziora Garbaś k. miejscowości Stare Juchy. Resztą materiału obsadzono eksperymentalnie stawki w ośrodku zarybieniowym Bryńsk koło Działdowa oraz wpuszczono do rzeki Brynicy. Według publikowanych doniesień (Gondko i Girsztowtt 1987, Jażdżewski i Konopacka 1995, Krzywosz i in. 1995) wyniki tych działań nie zaowocowały uzyskaniem trwałej populacji, choć ich autorzy zastrzegają możliwość przeżycia raka sygnałowego w miejscach introdukcji.
W 1979 roku raki pochodzące z następnej partii sprowadzonej ze Szwecji, liczącej w sumie 10 tysięcy osobników, przetrzymywano w basenach: Instytutu Rybactwa Śródlądowego w Olsztynie, Pracowni Rybactwa Rzecznego w Oliwie oraz ośrodka zarybieniowego w Naryjskim Młynie koło Morąga. Część tych raków (4200 osobn.) wypuszczono do wyrobiska pożwirowego koło Ełku, gdzie jeszcze do roku 1991 odławiano wyrośnięte osobniki. W 1983 roku 70 dorosłych osobników z wyżej opisanej partii wypuszczono do jeziora Szeląg Wielki k. Olsztyna. Ostatnią partię raków sygnałowych z ośrodka Simontorp sprowadzono do Polski w latach 1991 (7000 osobn.) - 1992 (3200 osobn.). Miejscem ich przetrzymywania były Ośrodek Zarybieniowy w Gawrych Rudzie (PZW) oraz Doświadczalny Ośrodek Zarybieniowy "Dgał" w Pieczarkach koło Giżycka (IRS). Celem tego importu było opracowanie metod hodowli gatunku (Krzywosz i in. 1995). W roku 1995 dorosłe osobniki pozostałe w tej hodowli sprowadzono do zamkniętych stawów hodowlanych w Żelicach k. Koszalina, należących do przedsiębiorstwa "Aquamar" z Miastka, zajmującego się hodowlą ryb i raków. W obiektach tych do dziś prowadzona jest z powodzeniem hodowla tego gatunku.
Na początku lat 90. rak sygnałowy pojawił się w dwu jeziorach leżących w pobliżu Drawieńskiego Parku Narodowego. Według zebranych informacji był to wynik nielegalnej introdukcji dorosłych raków przywiezionych ze Szwecji.
Aktualnie rak sygnałowy występuje w Polsce na co najmniej 18 stanowiskach naturalnych (Jażdżewski i Konopacka 1993, 1995; Krzywosz i in. 1995, Śmietana i Krzywosz 2005), z czego 11 zostało potwierdzonych w ostatnich trzech latach (P. Śmietana - dane niepubl.). Powstały one przede wszystkim w wyniku niekontrolowanych wsiedleń dokonywanych przez osoby, które nielegalnie weszły w posiadanie raków sygnałowych oraz ucieczek raków z obiektów hodowlanych. Gatunek w Polsce potencjalnie inwazyjny. | | | | | | Występowanie na terenach chronionych | | Nie stwierdzono występowania tego gatunku na terenach chronionych w Polsce. Natomiast znane są stanowiska raka sygnałowego leżące w bezpośrednim sąsiedztwie obszarów chronionych; są to Jez. Pobłędzie przy Parku Krajobrazowym Puszczy Romnickiej (Krzywosz T i Krzywosz W. 2001, 2002) oraz Jez. Adamów w Drawnie w otulinie Drawieńskiego Parku Narodowego (P. Śmietana - dane niepubl.). | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Znajomość wpływu raka sygnałowego na rodzime ekosystemy Polski jest skromna i dotyczy głównie jego bezsprzecznej roli jako nosiciela "dżumy raczej". Badania szwedzkie dowodzą, że jako plastyczny ekologicznie, bardzo płodny i szybko rosnący gatunek wypiera z naturalnych siedlisk raka szlachetnego, i to nawet w sytuacji, gdy nie obserwuje się transmisji dżumy raczej (Söderback 1993).
Rak sygnałowy jest typowym oportunistą troficznym (Momot i in. 1978), może korzystać z pokarmu zarówno niewielkich rozmiarów (mikrozooplankton, perifiton, detrytus), jak i dużych (makrofity). Chętnie żywi się larwami owadów bentonicznych (Mason 1975), a sam należy do ofiar dużych ważek, ryb bentosożernych i drapieżnych (Söderback 1991) oraz innych drapieżników. Niewątpliwie wpływa na tempo obiegu materii i energii w ekosystemach wodnych (Lewis 2002). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Ze względu na udowodnione przenoszenie "dżumy raczej" (Unestam 1969, Persson, Söderhäll 1983) gatunek jest bardzo niebezpieczny dla rodzimych gatunków raków z rodzaju Astacus. W przypadku współwystępowania wypiera konkurencyjnie raka szlachetnego (Söderback 1993). Tworząc silnie zagęszczone populacje może istotnie wpływać na biocenozy wodne poprzez oddziaływania troficzne.
Oprócz "agresywnych" metod eliminacji raka sygnałowego przy pomocy pestycydów (Peay i in. 2006) nie ma do tej pory sposobu eliminacji gatunku z wód europejskich, tym samym i polskich.
Rak sygnałowy tak pod względem taksonomicznym, jak i ekologicznym jest bardziej podobny do rodzimego raka szlachetnego niż innego introdukowanego z Ameryki Płn. gatunku - raka pręgowatego Orconectes limosus. Z tego punktu widzenia wydaje się być bardziej odpowiednim gatunkiem do utrzymania w wodnych ekosystemach europejskich. Ostatnio pogląd ekologów na obecność raka sygnałowego w wodach europejskich jest zdecydowanie mniej pozytywny. Natomiast z gospodarczego punktu widzenia rak sygnałowy jest gatunkiem atrakcyjnym (duże rozmiary ciała, niskonakładowa łowność), toteż w ostatnich latach notuje się wzrost zainteresowania jego hodowlą w Polsce.
Paradoksalnie, wprowadzenie ochrony częściowej dla raka szlachetnego spowodowało dodatkowy wzrost popularności raka sygnałowego jako gatunku hodowlanego. Tym samym przyczyniło się do wzrostu zagrożenia dla rodzimego gatunku chronionego. Mimo istniejących zaleceń hodowli raka sygnałowego wyłącznie w zamkniętych obiektach, prawdopodobieństwo jego przedostania się do wód naturalnych jest bardzo wysokie. Brak jasnych uregulowań prawnych i organizacyjno-technicznych w kwestii warunków hodowli tego obcego gatunku powoduje dodatkowe utrudnienia kontroli jego występowania i rozprzestrzeniania się w kraju.
Prawnym narzędziem zapobiegającym kolejnym introdukcjom jest Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12.11.2001 r. (Dz. U. nr 138, poz. 1559 z późn. zm.) ze zmianą w paragrafie 8 (Dz. U. 2003, Nr 17, poz. 160), nakazujące niewpuszczanie schwytanych osobników raka sygnałowego z powrotem do wód, w tym także do tych, w których został złowiony. Rozporządzenie to stanowi unikalne rozwiązanie prawne w skali europejskiej, lecz bez upowszechniania może okazać się nieskutecznym, martwym prawem. | | | | | | Prognoza | | Dotychczasowe doświadczenia wskazują, że należy spodziewać się dalszej, niekontrolowanej introdukcji i samoczynnej ekspansji gatunku w wodach polskich. Historia rozsiedlania i dyspersji gatunku wskazuje, że w okolicach jego występowania należy oczekiwać dalszego rozprzestrzeniania się zwierzęcia. Dotyczy to zwłaszcza dorzeczy Drawy, Wieprzy i Pasłęki. Tak, jak w przypadku raka pręgowatego, szeroka popularyzacja wiedzy na temat szkodliwości wsiedleń staje się - w świetle dotychczasowych doświadczeń - sprawą o fundamentalnym znaczeniu.
Rak sygnałowy nie występuje na Słowacji, Ukrainie i Białorusi (Holdich 2002). Do wód Niemiec, Czech, Litwy i Obwodu Kaliningradzkiego został sprowadzony tak jak do Polski w celach hodowlanych (Holdich 2002). W wodach naturalnych wszystkich zasiedlonych krajów tworzy lokalne, punktowo rozsiedlone populacje. Ekspansja tego gatunku uzależniona jest od istniejących lokalnych uregulowań prawnych i ich przestrzegania przez szeroko pojętych użytkowników wód i hodowców. Dotychczasowe doświadczenia, zebrane w ramach działań sieci tematycznej CRAYNET, wskazują, że należy się spodziewać tu, jak i w pozostałych krajach Europy, postępującej ekspansji tego gatunku. | | | | | | Literatura | | - Abrahamsson S.A.A. 1971. Density, growth and reproduction in populations of Astacus astacus and Pacifastacus leniusculus in an isolated pond. Oikos. 22: 373-80.
- Bouchard R.W. 1977. Morphology of the mandible in holoarctic crayfishes (Decapoda: Astacidae and Cambaridae). Freshwater Crayfish 3: 425-452.
- Brinck P. 1983. Sture Abrahamsson Memorial Lecture: An ecologist's approach to dealing with the loss of Astacus astacus. Freshwater Crayfish 5: 239-253.
- Dana J.D. 1852. In: Crustacea, Part 1. United States exploring expedition during the years 1838, 1839, 1840, 1841, 1842 under the command of Charles Wilkes, U.S.N. Philadelphia: C. Sherman 13: 1-685.
- Daniels R.A. 1980. Distributions and status of crayfishes in the Pit River drainage, California. Crustaceana 38: 131-182.
- Gondko R., Girsztowtt Z. 1987. Zasiedlenie wód Polski nowym gatunkiem raka Pacifastacus leniusculus Dana. Kieleckie Studia Biologiczne 4: 133-143.
- Holdich D.M. 2000. The introduction of alien crayfish species into Britain for commercial exploitation - an own goal? Crustacean Issues 12, 85-97.
- Holdich D.M. 2002. Distribution of crayfish in Europe and some adjoining countries. Bulletin Français de la Peche et de la Pisciculture 367: 611-650.
- Holdich D.M. Harlioglu M.M., Firkins I. 1997. Salinity adaptations of crayfish in British waters with particular reference to Austropotamobius pallipes, Astacus leptodactylus, and Pacifastacus leniusculus. Estuarine, Costal and Shelf Science 44: 147-154.
- Huner J.V. 1994. Freshwater crayfish aquaculture. Cultivation of Freshwater Crayfish in North America. Food Products Press: 5-19.
- Jażdżewski K., Konopacka A. 1993. Survey and distribution of Crustacea, Malacostraca in Poland. Crustaceana 65: 176 - 191.
- Jażdżewski K., Konopacka A. 1995. Pancerzowce prócz równonogów lądowych. Malacostratca prócz Oniscoidea. Katalog fauny Polski, Cz. XIII, tom 1. Dział Wydawnictw Muzeum i Instytutu PAN, Warszawa.
- Kawai T., Hiruta M. 1999. Distribution of crayfish (Pacifastacus leniusculus and Cambaroides japonicus) in Lake Shikaribetsu and Shihoro, Hokkaido, Japan. Crayfish News 21 (3): 11.
- Kossakowski J. 1983. Some remarks on the biology of the crayfish Pacifastacus leniusculus. Roczniki Naukowe PZW: 368-376.
- Kossakowski J. Mnich M. Kossakowski G. 1975. The first introduction of the crayfish Pacifastacus leniusculus Dana, into Polish waters. Freshwater Crayfish 4: 195.
- Krzywosz T. 1994. Introdukcja raka sygnałowego Pacifastacus leniusculus Dana do wód Polski. Roczniki Naukowe PZW 7. 81-93.
- Krzywosz T., Chybowski Ł., Ulikowski D. 1995. Rak sygnałowy w Polsce - historia, stan obecny, perspektywy. Komunikaty Rybackie 1/95: 5-8.
- Krzywosz T., Krzywosz W. 2002. Observations of the signal crayfish Pacifastacus leniusculus (Dana) in a lake in the eastern Suwałki Lake District. Archives of Polish Fishery 10 (2): 255-267.
- Krzywosz T., Krzywosz W. 2001. Preliminary observations of an American crayfish Pacifastacus leniusculus (Dana) population at a new site in the Mazurian Lake District. Arch. Pol. Fish. 9 (2): 273-278.
- Lewis S.D. 2002. Pacifastacus. In: Holdich D.M. (ed.) Biology of Freshwater Crayfish. Blackwell Science Ltd.: 511-540.
- Mastyński J., Andrzejewski W. 2001. Cechy morfometryczne i rozpoznawalne raków występujących w Polsce. Wydawnictwo Akademii Rolniczej im. Augusta Cieszkowskiego w Poznaniu.
- Mason J.C. 1975. Crayfish production in a small woodland stream. Freshwater Crayfish 2: 449-479.
- Mason J.C. 1977. Artificial incubation of crayfish eggs. Freshwater Crayfish 3: 119-132.
- McGriff D. 1983. Growth, maturity, and fecundity of the crayfish, Pacifastacus leniusculus, from the Sacramento-San Joaquin Delta. California Fish and Game 69: 227-242.
- Momot W.T., Growing H., Jones P.D. 1978. The dynamics of crayfish and their role in ecosystems. The American Midland Naturalist 99 (1): 277-283.
- Peay S., Hiley P.D., Collen P., Martin I. 2006. Biocide treatment of ponds in Scotland to eradicate Signal crayfish. Bulletin Francais de la Peche et de la Pisciculture 380-381: 1363-1380.
- Persson M., Söderhäll K. 1983. Pacifastacus leniusculus (Dana) and its resistance to the parasitic fungus Aphanomyces astaci Schikora. Freshwater Crayfish 5: 292-298.
- Rutledge P.S., Pritchard A.W. 1981. Scope of activity in the crayfish Pacifastacus leniusculus. American Journal of Physiology 240: 87-92.
- Sheldon A.L. 1989. Reconnaissance of crayfish populations in western Montana. Montana Department of Fish, Wildlife, and Parks.
- Śmietana P., Krzywosz T. 2006. Determination of the rate of growth of Pacifastacus leniusculus, in Lake Pobłędzie using polymodal length frequency distribution analysis. Bulletin Français de la Peche et de la Pisciculture 380-381: 1229-1244.
- Śmietana P., Strużyński W. 1996. Uwagi do introdukcji raka sygnałowego (Pacifastacus leniusculus Dana) w wodach Polski. Chrońmy Przyrodę Ojczystą 6: 89-95
- Söderback B. 1991. Interspecific dominance and aggressive interaction in the freshwater crayfish Astacus astacus (L.) and Pacifastacus leniusculus (Dana). Canadian Journal of Zoology 69: 1321-1325.
- Söderback B. 1993. Population regulation in two co-occuring Crayfish species. Praca doktorska. Acta Universitatis Upsaliensis. Comprehensive Summaries of Uppsala Dissertations from the Faculty of Science 434: 7-26.
- Swahn J.Ö. 2004. The cultural history of crayfish. Bulletin Français de la Peche et de la Pisciculture 372-373: 243-262.
- Unestam T. 1969. Resistance to the crayfish plague in some American, Japanese and European crayfishes. Report. Institute Freshwater Research. Drottningholm. 49: 202-209.
| | | | | | Streszczenie | | Endemic to the northwestern USA and southern Canada. Introduced into Sweden in 1960s to boost stocks after populations had been affected by crayfish plague, then distributed by man throughout Europe, now present in at least 22 countries. Introduced into north-eastern Poland in 1972. After several introductions Pacific Crayfish occurs in at least 18 sites in Poland. Pacific Crayfish occupies a wide range of habitats from small streams to rivers, ponds, lakes and reservoirs. It feeds on a wide variety of animal and plant material. It is tolerant of brackish water and high temperatures. Mating and egg lying occurs during October and hatching occurs from April to June depending on water temperature. Egg numbers usually range from 200 to 400 (max. 540). Lifespan is up to 20 years. The species is a proven carrier of crayfish plague. A polytrophic, aggressive, fast growing and highly fecund species. It can have considerable impact on other freshwater organisms, and on its habitat due to its burrowing activities. It can be considered as a potentially expansive species. There is rapidly growing interest in culture of P. leniusculus in Poland. This creates danger of uncontrolled distribution of this species. | | | | | | Opracowanie | | Przemysław Śmietana | | | | |
|