
Carassius auratus gibelio (Bloch, 1782)
karaś srebrzysty
Prussian Carp |   | Rodzina | | Cyprinidae karpiowate | | Rząd | | Cypriniformes karpiokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
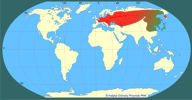
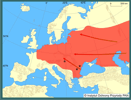
 | | | | | | Uwagi taksonomiczne | | Rodzaj Carassius jest w Europie reprezentowany przez jeden gatunek niewątpliwie autochtoniczny – jest nim karaś pospolity Carassius carassius. Systematyka jak i pochodzenie pozostałych taksonów – karasia srebrzystego C. gibelio i karasia złocistego vel złota rybka C. auratus – stanowi wciąż nierozwiązany problem taksonomiczny i zoogeograficzny. Zgodnie z filogenetyczną koncepcją gatunku nie są one konspecyficzne (Kottelat 1997), jednak w większości współczesnych opracowań ichtiofauny Europy tradycyjnie za Bergiem (1949) uznaje się je jako podgatunki: C. auratus auratus i C. auratus gibelio (Bănărescu 1992, Baruš i Oliva 1995, Szczerbowski 2000, 2001; Doadrio 2001). Dalsze trzy podgatunki C. auratus opisano na terenie Wysp Japońskich. Systematykę grupy dodatkowo komplikuje występowanie jednopłciowych populacji o aseksualnym systemie rozrodu i prawdopodobnym ich hybrydowym pochodzeniu (Vasil’eva i Vasil’ev 2000). Osobny problem stanowi poddawana pod wątpliwość ważność formalnego opisu gatunkowego C. gibelio dokonana przez Blocha (1782, cyt. za Kottelatem 1997) na podstawie materiałów ze środkowej Europy. Część rysunków i opisów dokumentujących tę pracę odpowiada wprawdzie cechom diagnostycznym karasia srebrzystego (Berg 1949, Hensel 1971), jednak przeprowadzona ostatnio rewizja materiałów typowych wykazała, że należą one do C. carassius (Kalous i in. 2004). Prowadzone aktualnie badania filogenetyczne na podstawie markerów genetycznych wskazują jednoznacznie na dalekowschodnie pochodzenie karasia srebrzystego. Sugerowane jest też utrzymanie gatunkowej rangi tego taksonu (Kalous i Šlechtová 2004, Kalous i in. 2004). | | | | | | Locus typicus/Terra typica | | Nieznany. | | | | | | Pierwotna ojczyzna gatunku | | Rozpoznanie pierwotnego zasięgu występowania Carassius gibelio jest już prawdopodobnie niemożliwe. Doniesienia o występowaniu karasia o morfologii przypominającej C. gibelio na terytorium Europy datowane są od XVI wieku i sprawiają, iż bywa on czasem uznawany za autochtoniczny dla tego kontynentu (Hensel 1971, Kottelat 1997). Zapewne jest to jednak gatunek azjatycki, na co wskazuje bliskie filogenetyczne pokrewieństwo (wykazane na podstawie badań mitochondrialnego DNA) osobników europejskich do dalekowschodnich (Kalous i Šlechtová 2004). Liczne przesiedlenia i introdukcje karasi jako ryb ozdobnych, prowadzone od czasów starożytnych powodują, że stały się one jednymi z najszerzej rozsiedlonych ryb na świecie. Szczerbowski (2001) opisując naturalny zasięg występowania C. auratus (wraz z uznanym za podgatunek karasiem srebrzystym - C. auratus gibelio) podaje dorzecze Amuru, obszar obejmujący Chiny z Mandżurią, Koreę, Japonię i Tajwan. Według Berga (1949) zwarty zasięg występowania C. auratus gibelio rozciąga się na terenie Azji od Korei i Sachalinu przez dorzecza Amuru, Kołymy, Leny, po jeziora basenu Syr-darii i deltę Amu-darii. Wyspowe stanowiska zlokalizowane są też w rzekach syberyjskich - Zajsan, Czarny Irtysz oraz na kontynencie europejskim w delcie Wołgi i w okolicach St. Petersburga, gdzie prawie na pewno został wsiedlony. Za gatunek pochodzący z Dalekiego Wschodu (Chiny), który za pośrednictwem człowieka rozprzestrzenił się w Eurazji, uważa go też Bănărescu (1993, za Kottelatem 1997). Na skutek masowych introdukcji i translokacji karaś srebrzysty występuje obecnie na znacznym obszarze Azji (Reshetnikov 2002, Podushka i in. 2003) i Europy od zlewiska Wołgi po Ren (Szczerbowski 2001, Özulug i in. 2004), natomiast karaś złocisty to jedna z najpowszechniej introdukowanych ryb w ciągu kilku ostatnich wieków w wodach śródlądowych, obecna na wszystkich kontynentach (Welcomme 1988). | | | | | | Podstawowe cechy morfologiczne | | Osobniki żyjące na wolności w wodach Europy osiągają długość 15-20 cm i ciężar ciała 200-300 g. Ciało tego karasia jest wrzecionowate, lekko dwubocznie spłaszczone (najwyższa wysokość ciała stanowi 30-50% jego długości). Typ pyska - półdolny. Płetwa grzbietowa długa o krawędzi lekko wciętej lub prostej. Ostatni z jej promieni nierozgałęzionych przekształcony jest w kolec o tylnej krawędzi zaopatrzonej w 10-11 ząbków. Podobne ząbki występują też na analogicznym promieniu w płetwie odbytowej. W płetwie ogonowej zaznacza się wyraźne wcięcie. Gęsty aparat filtracyjny zaopatrzony jest w 38-54 wyrostków. Całe ciało (z wyjątkiem głowy) pokryte dużymi łuskami cykloidalnymi (w linii nabocznej 21-36 łusek). Srebrzyste ubarwienie boków ciała przechodzi stopniowo w ciemnostalowe na grzbiecie (może wpadać w odcień granatowy) i białe na brzuchu. Płetwy nieparzyste są ciemnoszare, parzyste - znacznie jaśniejsze (Rolik i Rembiszewski 1987, Szczerbowski 2001). Obserwuje się dużą plastyczność zależną od czynników środowiskowych w proporcjach ciała i ubarwieniu (Baruš i Oliva 1995). Dymorfizm płciowy ogranicza się do nieznacznych różnic w kilku cechach biometrycznych, jak wysokość ciała i długości płetw (Szczerbowski 2001). | | | | | | Biologia, ekologia | | Karaś srebrzysty jest gatunkiem ciepłolubnym o niskich wymaganiach co do jakości wody. Należy do najbardziej wytrzymałych ryb słodkowodnych na niską zawartość tlenu, ekstremalne temperatury i podwyższoną mętność wody na wszystkich etapach ontogenezy. Tolerancja na zasolenie pozwala mu kolonizować zatoki morskie (Winkler i in. 2000, Szczerbowski 2001, Vetemaa i in. 2005). Jego typowe siedliska to stawy, jeziora eutroficzne w strefie litoralnej i rzeki nizinne, zwłaszcza ich starorzecza i zastoiska. Preferuje miejsca płytkie o miękkim dnie, porośnięte roślinnością naczyniową i bogatej w nutrienty wodzie, często przy znacznym udziale zawiesin. Pod koniec lata przemieszcza się w nieco głębsze strefy - do 2,5 m (Rolik i Rembiszewski 1989, Szczerbowski 2001). Zasiedla też ujścia rzek i przybrzeżne, wysłodzone wody morskie, gdzie może stać się nawet dominującym gatunkiem (np. w Bałtyku u wybrzeży Estonii - Vetemaa i in. 2005). Często spotykany jest też w stagnujących odcinkach rzek podgórskich i górskich - w zbiornikach tworzących się poniżej sztucznych progów piętrzących wodę (np. Witkowski i in. 2000). Obecność karasi srebrzystych w takich miejscach jest zazwyczaj wynikiem ich przenikania z pobliskich stawów. W skład bardzo szerokiego spektrum pokarmowego C. gibelio wchodzą zarówno organizmy bentosowe, jak i planktoniczne, a także detrytus, fragmenty roślinne i sinice. Żeruje na dennych i planktonicznych skorupiakach, larwach owadów, mięczakach, ikrze i wylęgu ryb, uzależniając swój wybór od aktualnej dostępności danego rodzaju pokarmu. Zazwyczaj poszukuje pokarmu w miejscach płytkich, gęsto zarośniętych roślinnością. Dzięki gęstemu aparatowi filtracyjnemu jest też w stanie odżywiać się drobnymi organizmami planktonowymi (Szczerbowski 2000, 2001). Dojrzałość płciową osiąga w wieku 2-5 lat. W warunkach europejskich do tarła przystępuje wiosną (koniec maja) przy temperaturze wody 18-19°C. Płodność absolutna jest bardzo zróżnicowana i w zależności od rozmiarów samicy może wynosić od 30 000 do niemal 400 000 ziaren ikry. Tarło jest wieloporcyjne; zwykle odbywa się dwu-,trzykrotnie w ciągu sezonu rozrodczego. Ikra składana jest w miejscach gęsto porośniętych roślinnością, do której przytwierdzana jest kleistą otoczką jajową (fitofilna grupa rozrodcza). W ramach współczesnego rozmieszczenia karasia srebrzystego zaobserwowano, że w przemieszczających się na zachód poszczególnych populacjach rośnie udział samic w stosunku do samców. W europejskiej części areału tego gatunku obserwuje się zwykle już tylko populacje jednopłciowe (Berg 1949, Holčik 1980). Na tym obszarze karaś srebrzysty rozmnaża się klonalnie poprzez gynogenezę. Ten sposób rozrodu nie wymaga zaplemnienia komórki jajowej, a do aktywacji rozwoju jaja wystarcza jego krótkotrwały kontakt ze spermą innych gatunków ryb karpiowatych. Synchroniczne tarło zapewnia im pobudzenie ikry dzięki stymulującemu działaniu obecnego w tarlisku mleczu. Koegzystencja osobników poliploidalnych i diploidalnych (w tym samców) w niektórych populacjach europejskich sugeruje, że wśród nich istnieją też bardziej skomplikowane aseksualno-seksualne systemy rozrodcze (Vasil'eva i Vasil'ev 2000, Halačka i in. 2003). Zdolność do rozmnażania klonalnego umożliwia bardzo szybki przyrost naturalny. Ta cecha biologiczna stanowi o sukcesie i szczególnej inwazyjności C. gibelio. Podobnie jak ikra, rozwijające się zarodki są silnie przytwierdzone do roślinności lub innych stałych elementów podłoża. Aktywny tryb życia rozpoczynają po 8-10 dniach od wyklucia z osłon jajowych (Szczerbowski 2001). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Pojawienie się karasia srebrzystego w Europie, podobnie jak jego pochodzenie są wciąż kwestią podlegającą dyskusji. Jedna z hipotez zakłada, że jest on wtórnie zdziczałą (lub pochodzącą z hybrydyzacji) formą karasia złocistego Carassius auratus, sprowadzonego do Europy w XVII wieku. Historię tej introdukcji opisał Kottelat (1997) na podstawie dokumentacji zebranej przez Valenciennes'a; wynika z niej, że C. auratus - jako ryba ozdobna, aklimatyzowana powszechnie na Dalekim Wschodzie - został sprowadzony do Portugalii w 1611 lub 1691 roku z jednej z farm tego gatunku na Jawie. Niezależnie sprowadzono go do Anglii (1691), a następnie Francji (1755). Od czasu opracowania metod rozmnażania go w hodowli (po raz pierwszy w Holandii w 1728) stopniowo był przenoszony do niemal wszystkich krajów europejskich. Pogląd, jakoby ucieczki z hodowli dawały początek ekspansjom tego gatunku w Europie, budzi jednak wątpliwość. Koszty transportu i późniejszego utrzymania były bardzo wysokie, toteż prawdopodobnie ryby te były pilnie strzeżone przed swobodnym przenikaniem do wód otwartych. Ponadto należałoby założyć, że podobne czynniki zdecydowały o jego szerokim rozprzestrzenieniu na Syberii. Pierwsze doniesienia o występowaniu ryby odpowiadającej pod względem morfologicznym C. gibelio pochodzą z pracy Gesnera (1560) i prac podawanych przez Blocha (1750), i dotyczą Europy Środkowej (cyt. za Kottelatem 1997). Pochodzą one z okresu wcześniejszego niż sprowadzenie na nasz kontynent C. auratus. Sugeruje to, iż karaś srebrzysty jest gatunkiem bądź autochtonicznym, bądź obcym, który pojawił się w Europie nieznaną drogą. Te historyczne doniesienia nie są jednak w pełni wiarygodne, ponieważ mogły odnosić się do karasia pospolitego C. carassius - gatunku o dużej zmienności fenotypowej (Holopainen i in. 1997). Seria osobników typowych dla gatunku C. gibelio, zdeponowanych w Naturkunde Museum w Berlinie, to w rzeczywistości C. carassius (Kalous i in. 2004). Alternatywną koncepcję zasiedlenia Europy przez karasia srebrzystego przedstawił Bănărescu (1993, za Kottelatem 1997). Jego zdaniem, była to powszechnie hodowana w stawach w Chinach ryba konsumpcyjna, która wraz z upowszechnianiem akwakultury w wiekach średnich, poprzez kraje islamskie Bliskiego Wschodu, dostała się do wschodniej Europy. Holčik i Žitňan (1978) wyróżniają trzy centra występowania wzmiankowane w pierwszej połowie XX wieku, z których rozpoczęła się inwazja; są to: 1) delta Dunaju, obejmująca fragmenty obszarów Rumunii i Ukrainy; 2) graniczny fragment Dunaju między Rumunią a Bułgarią, na północ od Sofii; 3) dorzecze Cisy, obejmujące część Bułgarii, Serbii i Węgier. Z tych centrów C. gibelio rozprzestrzeniał się najpierw w kierunku północnym, a następnie zachodnim, zajmując stopniowo kolejne kraje Europy. Autorzy ci nie uwzględnili jednak wcześniej wzmiankowanych introdukcji w Polsce (np. Gąsowska 1934), gdzie niezależnie mogły powstać centra rozprzestrzenienia. W pierwszej połowie XX wieku karaś srebrzysty stał się popularnym gatunkiem gospodarczym, translokowanym na szeroką skalę w obrębie byłego ZSRR i krajów regionu czarnomorskiego. Szczyt inwazji przypadł na lata 70. XX wieku (Szczerbowski 2001). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Najstarsze informacje o występowaniu karasia srebrzystego na dzisiejszym obszarze Polski pochodzą z terenów Prus i Śląska XVI i XVII wieku (Rolik i Rembiszewski 1987, Kottelat 1997), jednak najprawdopodobniej dotyczą one karasia pospolitego C. carassius i nie mogą być uznane za dowody świadczące o występowaniu tego pierwszego gatunku (Kalous i in. 2004). Pierwsze udokumentowane stwierdzenie Carassius gibelio w Polsce dotyczy gospodarstwa Lubella pod Żółkwią na północ od Lwowa (dziś Ukraina) i stawów obecnego woj. świętokrzyskiego w roku 1933 (Gąsowska 1934). W latach 40. notowano go też w stawach dawnego województwa warszawskiego i lubelskiego (Staff 1950). Postępy inwazji karasia srebrzystego nie były na bieżąco monitorowane, jednak w kolejnych opracowaniach ichtiofauny Polski zwraca uwagę rosnąca powszechność występowania tej ryby w naszych wodach. Staff (1950) podaje obszar występowania karasia srebrzystego w ograniczeniu do Mazowsza i Kielecczyzny. Gąsowska (1962) określa go jako gatunek towarzyszący karpiowi, nieliczny w jeziorach i stawach, nie precyzuje jednak granic zajmowanego areału, ponieważ prawdopodobnie obejmował on już wtedy całą Polskę. Rolik i Rembiszewski (1987) oceniają go jako gatunek rzadszy od karasia pospolitego, nieco liczniej występujący tylko w południowych i centralnych regionach kraju. Według Witkowskiego (1996) karaś ten został odnotowany już w ponad 50% zlewisk większych rzek Polski. Dane zgromadzone z opracowań ichtiofauny Polski z ostatnich 20 lat wskazują, że pod względem liczby stanowisk C. gibelio przewyższył już C. carassius. Dziś w stawach typu karpiowego karaś srebrzysty występuje w Polsce powszechnie i można go uznać za najliczniejszy gatunek ryby obcego pochodzenia w naszym kraju. Pojawienie się karasia srebrzystego jest prawdopodobnie wynikiem sprowadzenia materiału zarybieniowego karpia Cyprinus carpio z domieszką tegoż gatunku (Gąsowska 1934, Witkowski 1989). Ustalenie źródeł jego pochodzenia jest obecnie niemożliwe. Zasadniczy kierunek ekspansji karasia srebrzystego w Europie w XX w. przebiegał z południowego wschodu (dolny Dunaj, Cisa) na zachód i północ, co pozwala przypuszczać, że do Polski przybył z Ukrainy lub Rumunii. Początkowo rozprzestrzeniał się on przypadkowo wraz materiałem zarybieniowym karpia (Staff 1950, Gąsowska 1962). Później stanowił tzw. dodatkową obsadę stawów, stając się gatunkiem gospodarczym. Obiekty hodowlane nigdy nie są tak skutecznie izolowane, aby ryby nie przenikały z nich do wód otwartych (Witkowski, Paszkowski 2002). Tą drogą C. gibelio bardzo szybko rozprzestrzeniał się w kolejnych dorzeczach. Drugim wektorem dyspersji były zarybienia prowadzone w celu uatrakcyjnienia łowisk wędkarskich. Z racji łatwości transportu tych ryb (odporność na krótkotrwałe deficyty tlenowe) zajmowały się tym nie tylko organizacje wędkarskie, ale i prywatne osoby. Moda na połowy wędkarskie karasia srebrzystego trwała do lat 90. XX w. W tym czasie był on też powszechnie stosowany jako żywa przynęta w połowach na ryby drapieżne. Ucieczki i uwalnianie ryb w miejscu połowów to istotny czynnik, który sprzyjał rozszerzaniu areału występowania karasia srebrzystego. Kolejnym czynnikiem pochodzenia antropogenicznego, wzmagającym jego inwazję, jest znacząca redukcja miejsc tarliskowych przez regulacje i tzw. konserwacje rzek. Cechy biologiczne C. gibelio (odporność na zanieczyszczenia, klonalny sposób rozrodu) pozwoliły mu szybciej kolonizować zdegradowane siedliska niż konkurującym z nim rybom karpiowatym. Zbiegający się w tym samym czasie spadek liczebny ryb drapieżnych, które regulują wielkość populacji karpiowatych (szczupak Esox lucius, sandacz Stizostedion lucioperca, sum Silurus glanis, boleń Aspius aspius; Holčik 1980), promował karasia srebrzystego w zajmowaniu przekształconych nisz ekologicznych.
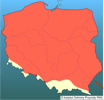
Obecnie gatunek ten należy do najczęściej spotykanych ryb w ichtiofaunie słodkowodnej Polski. Pospolity jest zwłaszcza na niżu, zarówno w stawach hodowlanych, jak i wodach otwartych - stojących i płynących. Często spotykany jest też w ciekach o charakterze podgórskim, na odcinkach o spowolnionym przepływie wody (zwykle poniżej urządzeń piętrzących), gdzie ryby te dostają się ze stawów. Obecność karasia srebrzystego odnotowano m.in. w wodach Sanu i niektórych jego dopływów w Bieszczadach i Beskidzie Niskim; ponadto w Wiśle k. Skoczowa, Czarnej Orawie, Sole, Ropie, Białej Dunajcowej, Kwisie, Nysie Kłodzkiej, Nysie Łużyckiej, Kaczawie, Bobrze i Bystrzycy (Rembiszewski i Rolik 1975, Skóra i Włodek 1988, Skóra i in. 1994, Augustyn i in. 1998, Witkowski i in. 2000). Stale odnotowuje się go też w większości rzek przymorskich (Dębowski i in. 2001). | | | | | | Występowanie na terenach chronionych | | Jest mieszkańcem większości parków narodowych i krajobrazowych, z wyjątkiem typowo górskich, jak Tatrzański Park Narodowy, Babiogórski Park Narodowy i Karkonoski Park Narodowy. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Wpływ tego karasia na rodzime gatunki przejawia się na czterech płaszczyznach: 1) jest konkurentem o zasoby dla innych gatunków ryb karpiowatych, a zwłaszcza dla karasia pospolitego Carassius carassius, lina Tinca tinca, a w nieco mniejszym stopniu dla różanki Rhodeus amarus i słonecznicy Leucaspius delineatus (Lusk i in. 2004); 2) żeruje na ikrze współwystępujących ryb autochtonicznych, doprowadzając do zmniejszania sukcesu rozrodczego gatunków rodzimych; 3) jest przenosicielem dalekowschodnich pasożytów i chorób, w tym endopasożytów z grupy robaków (helmintów; Holčik i Žitňan 1978) stanowiących zagrożenie dla ryb europejskich; 4) zakłóca tarło rodzimych ryb karpiokształtnych przez wchodzenie z nimi w kontakt rozrodczy (gynogeneza), co w konsekwencji obniża odsetek zapłodnionych jaj gatunków wykorzystywanych do gynogenezy. Dotychczas stwierdzono, że spośród rodzimej ichtiofauny do aktywacji jaj karasia srebrzystego wykorzystywane są plemniki: karasia pospolitego, lina, płoci Rutilus rutilus, wzdręgi Scardimus erythrophthalmus, leszcza Abranis brama, klenia Leuciscus cephalus, brzany Barbus barbus, a nawet należącego do innej rodziny piskorza Misqurnus fossilis (Szczerbowski 2001). Szybsze tempo klonalnego rozrodu C. gibelio niż koegzystujących z nim gatunków rodzimych powoduje, że w krótkim czasie zdobywa on przewagę liczebną w zespołach ichtiofauny. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Oddziaływanie karasia srebrzystego na rodzimą ichtiofaunę, jak wykazano wyżej, nie jest obojętne, jakkolwiek nie stwarzało dotychczas zjawisk klęskowych, tak też i w gospodarce rybackiej gatunek ten - poprzez konkurencyjność i zmianę struktury rybostanów- może przynosić wymierne szkody ekonomiczne.
Karaś srebrzysty nie podlega innym aktom prawnym niż ogólne postanowienia, zawarte w ustawie "o ochronie przyrody" z dnia 16 kwietnia 2004 r. art. 120, dotyczące zakazu wprowadzania do środowiska przyrodniczego i przemieszczania zwierząt obcego pochodzenia (Dz. U. 2004, nr 92, poz. 880). Ustawa ta zezwala jednak na introdukcję w ramach "racjonalnej gospodarki leśnej i rolnej". W Regulaminie amatorskiego połowu ryb PZW nie stosuje się dla niego limitów połowowych ani wymiaru czy okresu ochronnego.
Zalecanym działaniem profilaktycznym powinna być kontrola czystości materiału zarybieniowego karpia przy obsadzaniu stawów hodowlanych. Zaniechanie promocji połowów tego gatunku wśród wędkarzy przyczyniłoby się do zmniejszenia zainteresowania w utrzymywaniu karasia srebrzystego w naszych wodach. | | | | | | Prognoza | | Gatunek ten zaaklimatyzował się w Polsce i stał się jednym z najbardziej wszędobylskich mieszkańców wód śródlądowych. Jego inwazja osiągnęła stan kulminacyjny i nic, jak na razie, nie wskazuje aby sytuacja ta uległa zmianie. | | | | | | Literatura | | - Augustyn L., Bieniarz K., Skóra S., Włodek J.M. 1998. Ichtiofauna dorzecza rzeki Ropy. Roczniki Naukowe Polskiego Związku Wędkarskiego 11: 29-50.
- Bănărescu P. 1992. Zoogeography of fresh waters. Vol. 2. Distribution and dispersal of freshwater animals in North America and Eurasia. Aula, Wiesbaden, Germany 1-1091.
- Baruš V., Oliva O. 1995. Mihulovci Petromyzontes a ryby Osteichthyes (2). Academia, Praha 1995: 1-698.
- Berg, L.S., 1949. Ryby presnych vod SSSR i sopredelnych stran. 2. Izdatelstvo Akademii Nauk SSSR, Moskva-Leningrad: 469-925.
- Dębowski P., Heese T., Radtke G., Arciszewski M. 2001. Stan poznania ichtiofauny rzek i jezior Pomorza. Roczniki Naukowe Polskiego Związku Wędkarskiego14 (Suppl.): 93-128.
- Doadrio I. (ed). 2001. Atlas y Libro Rojo de los Peces Continentales de Espana. Direction General de Conservacion de la Naturaleza, Museo Nacional de Ciencias Naturales, Madrid. Gąsowska M. 1934. Karaś srebrzysty - Carassius gibelio (Bloch), jako nowy składnik ichtiofauny wód Polski. Przegląd Rybacki 7: 261-266.
- Gąsowska M. 1962. Klucze do oznaczania kręgowców Polski. Część I. Krągłouste - Cyclostomi i Ryby - Pisces. Państwowe Wydawnictwo Naukowe, Warszawa: 1-240.
- Halačka K., Lusková V., Lusk S., 2003. Carassius "gibelio" in the fish communities of the Czech Republic. Ecohydrology and Hydrobiology 3: 133-138.
- Hensel K. 1971. Some notes on the systematic status of Carassius auratus gibelio (Bloch 1782) with further record of this fish from the Danube River in Czechoslovakia. Vestnik Československej Společnosti Zoologickej 35: 186-198.
- Holčik J. 1980. Possible reason for the expansion of Carassius auratus (L.) (Teleostei, Cyprinidae) in the Danube River Basin. International Revue geseltschaft fuer Hydrobiologie 65 (5): 673-679.
- Holčik J., Žitňan R. 1978. On the expansion and origin of Carassius auratus in Czechoslovakia. Folia Zoologica 27(3): 279-288.
- Holopainen I. J., Tonn W. M., Paszkowski C. A. 1997. Tales of two fish: the dichotomous biology of crucian carp (Carassius carassius L.) in northern Europe. Annales Zoologici Fennici 34: 1-22.
- Kalous L., Šlechtová V. 2004. Carassius gibelio Autochthonous or Exotic Species in Europe: Molecular Phylogenetic Evidence. Proceedings of XI European Congress of Ichthyology, Tallinn, Estonia, September 6-10, 2004: 122-122.
- Kalous L., Bohlen J., Ráb P. 2004. What fish is Carassius gibelio: Taxonomic and Nomenclatoric notes. Proceedings of XI European Congress of Ichthyology, Tallinn, Estonia, September 6-10, 2004: 26-27.
- Kottelat M. 1997. European freshwater fishes. Biologia (Bratislava) 52 (Suppl. 5): 1-271.
- Lusk S., Koščo J., Lusková V., Halačka K., Košuth P. 2004. Alien fish species in the floodplains of the Dyje and the Bodrog rivers. Ecohydrology and Hydrobiology 4(2): 199-205
- Özulug M., Meriç N. & Freyhof J. 2004. The distribution of Carassius gibelio (Bloch, 1782) (Teleostei: Cyprinidae) in Thrace (Turkey). Zoology in the Middle East 31: 63-66.
- Podushka S.B. 2003. Goldfish in waterbodies from Northern Caucasus. Zhivotnyje v antropogennym landshafte. Materialy nauchno-prakticheskich konferencji. Astrakhan'. 14-16. 05. 2003. Astrakhan': 50-52.
- Rembiszewski J.M., Rolik H. 1975. Katalog Fauny Polski. Cz. 38. Krągłouste i Ryby - Cyclostomata et Pisces. Państwowe Wydawnictwo Naukowe, Warszawa: 1-252.
- Reshetnikov J.S. 2002. Atlas presnowodnych ryb Rosji. Tom 1. Izd. Nauka, Moskwa: 1-382.
- Rolik H., Rembiszewski J.M. 1987. Fauna Słodkowodna Polski. Zeszyt 5: Ryby i krągłouste (Pisces et Cyclostomata). Państwowe Wydawnictwo Naukowe, Warszawa: 1-317.
- Skóra S., Włodek J. M. 1988. Ichtiofauna rzeki Soły i jej dopływów. Roczniki Naukowe Polskiego Związku Wędkarskiego 1: 97-121.
- Skóra S., Włodek J. M, Augustyn L., Nawrocki J. 1994. Ichtiofauna dorzecza Białej Dunajcowej. Roczniki Naukowe Polskiego Związku Wędkarskiego 7: 19-37.
- Staff F. 1950. Ryby słodkowodne Polski i krajów ościennych. Trzaska, Evert i Michalski, Warszawa: 1-286.
- Szczerbowski A. 2000. Karaś srebrzysty Carassius auratus gibelio (Bloch, 1783). W: Brylińska M. (red.) Ryby słodkowodne Polski. Państwowe Wydawnictwo Naukowe, Warszawa: 1-524.
- Szczerbowski J.A. 2001. Carassius auratus (Linneaus, 1758). In: Banarescu P.M. and Paepke H.-J. (eds) The Freshwater Fishes of Europe, 5/III Cyprinidae 2. Part III: Carassius to Cyprinus Gasterosteidae. AULA-Verlag: 5-41.
- Vasil'eva E.D., Vasil'ev V. 2000. K problemie proiskhozhdenija i taksonomicheskogo statusa triploidnoj formy serebrannogo karasja Carassius auratus (Cyprinidae). Voprosy Ichtiologii 40 (5): 581-592.
- Vetemaa M., Eschbaum R., Albert A., Saat T. 2005. Distribution, sex ratio and growth of Carassius gibelio (Bloch) in coastal and inland waters of Estonia (north-eastern Baltic Sea). Journal of Applied Ichthyology 21 (4): 1-287.
- Welcomme R.L. 1988. International introductions of inland aquatic species. FAO Fisheries Technical Paper 294: 1-318.
- Winkler H.M., Skóra K., Repecka R., Ploks A., Neelov A., Urho L., Gushin A., Jespersen H. 2000. Checklist and status of fish species in the Baltic Sea. International Council for the Exploration of the Sea 2000: 11, 15-15.
- Witkowski A. 1989. Introdukowane ryby w polskich wodach i ich wpływ na środowisko. Przegląd Zoologiczny 33: 581-598.
- Witkowski A. 1996. Introduced fish species in Poland: pros and cons. Archiwum Rybactwa Polskiego 4 (1): 101-112.
- Witkowski A., Błachuta J., Kotusz J., Kusznierz J. 2000. Lampreys and Fishes of the upper and middle Odra basin (Silesia, SW Poland) - The present situation. Acta Hydrobiologica 42 (3/4): 283-303.
- Witkowski A., Paszkowski P. 2002. The impact of ponds and hatcheries on the ichthyofauna of the Dobra River (central Oder River tributary). Archiwum Rybactwa Polskiego 10 (2): 207-219.
| | | | | | Streszczenie | | The Prussian Carp originated in southeastern Asia. The precise delimitation of its natural range is impossible because since ancient times numerous translocations have been carried out in Asia. As the result of introductions and translocations carried out during the past several centuries it is now one of the widest distributed fish species in Asia and Europe; present also in all other continents. In the area of Poland it was first found in 1933, in ponds near Lviv (now Ukraine) and in the then Świętokrzyskie Voivodship. Irrespective of different hypotheses trying to explain the appearance of this species in Europe, it is most probable that Prussian Carp was introduced to Poland with carp stocking material from the estuaries of the Danube and Cisa rivers (Ukraine and Romania). Intentional of unintentional transfer of fry between carp farms and carp stocking of the fishing grounds contributed to its further successful expansion in our country. Typical habitats of C. gibelio are ponds, eutrophic lakes and lowland rivers, and particularly ox-bow lakes and pools. It shows high resistance to water pollution, oxygen deficit, salinity and extreme temperatures. It is also a food opportunist of a clonal mode of reproduction (gynogenezis). Prussian Carp has a negative influence on native species because it competes for environmental resources with other cyprinids, predates on fish eggs, is a carrier of Asiatic parasites and disturbs the spawning of fish of a sexual mode of reproduction. Specific features of the biology of this species, combined with human activity favoring its expansion, have caused that the Prussian carp has acclimatized in the inland waters of Poland and become the commonest foreign species in our ichthyofana. | | | | | | Opracowanie | | Jan Kotusz | | | | |
|