
Dreissena polymorpha (Pallas, 1771)
racicznica zmienna
Zebra Mussel |   | Rodzina | | Dreissenidae racicznicowate | | Rząd | | Eulamellibranchia blaszkoskrzelne | | Gromada | | Bivalvia małże | | Typ | | Mollusca mięczaki | | |
 | |  | | | | | | | | |
 | | | | | | Locus typicus/Terra typica | | Północna część Morza Kaspijskiego i rzeka Jaik (obecnie Ural). | | | | | | Pierwotna ojczyzna gatunku | | Formy bliskie racicznicy, wywodzące się z rodzaju Congeria, spotykane są już w pokładach dolnoplioceńskich (Giljarov 1970). W okresie przed zlodowaceniem występowała ona wzdłuż Wołgi oraz w Europie Środkowej na dość znacznym obszarze (Andrusov 1897, Wesenberg-Lund 1939, Žadin 1946, Morduchaj-Boltovskoj 1965). W okresie lodowcowym Dreissena polymorpha wymarła prawie na całym obszarze Europy, a reliktowy areał pozostał na wybrzeżach Mórz Czarnego, Azowskiego i Kaspijskiego. Wyginięcie wiązane jest z dużą ilością zawiesiny mineralnej w wodzie, która mogła powodować uszkodzenia delikatnych syfonów i skrzeli małży (Urbański 1957, Jaeckel 1967, Nowak 1971). Niektórzy autorzy uważali, że w Europie zachowało się nieprzerwanie kilka reliktowych stanowisk tego gatunku (Szlezwik-Holsztyn, Zalew Kuroński, jezioro Ochryda, Turyngia, Nizina Węgierska (Schröter 1779, Shadin 1935, Raabe 1956, Nowak 1974). | | | | | | Podstawowe cechy morfologiczne | | Dreissena polymorpha jest małżem słodkowodnym średniej wielkości, długość maksymalna wynosi 25-40 mm, wysokość 13-18 mm, szerokość 17-23 mm (Piechocki i Dyduch-Falniowska 1993, Sarnowska i Lewandowski 2003). Muszla w zarysie trójkątna, podobna w kształcie do racicy - stąd polska nazwa rodzajowa (nazwa niemiecka - Dreikantmuschel). Nazwa gatunkowa polska i łacińska związane są z dużą zmiennością kształtu i barwy muszli. Nazwa angielska mówi o ciemnych paskach na jej powierzchni. W niektórych populacjach występują, nieraz bardzo licznie, formy albinotyczne (Świerczyński 1994). | | | | | | Biologia, ekologia | | Dreissena polymorpha jest gatunkiem łatwo dostosowującym się do różnych warunków środowiskowych i troficznych. Występuje w wodach słodkich i słonawych (do 6 ppt). Racicznice są rozdzielnopłciowe. Szybko osiągają dojrzałość płciową, czasami nawet w pierwszym roku życia. Stosunek liczby samców do samic w populacji wynosi najczęściej 1:1. Zapłodnienie następuje w wodzie. Liczba produkowanych jaj przez samicę w ciągu sezonu oceniana jest przez różnych autorów w szerokich granicach - od 40 tysięcy nawet do 1 miliona (Kačanova 1961, Sprung 1993). Z jaja rozwija się larwa typu trochofora, przekształcająca się dość szybko w kolejne stadium larwalne - veliger. W klimacie umiarkowanym larwy w planktonie stwierdzane są zwykle od maja do początku września, ale w wodach podgrzanych - dłużej, od marca-kwietnia. Pojedyncze veligery utrzymują się w planktonie, w zależności od warunków, od 10 do 24 dni. Po osiągnięciu 200-300 ?m długości larwy opadają na dno jako tzw. postveligery. Warunkiem dalszego rozwoju jest znalezienie odpowiedniego (trwałego) podłoża, do którego przytwierdzają się nićmi bisiorowymi. Moment przechodzenia z planktonowego do osiadłego trybu życia związany z jest z dużą redukcją (ponad 90%) liczebności małży (Wiktor 1969, Stańczykowska 1977, Lewandowski 1982). Jednym z możliwych podłoży, jaki znajdują larwy w litoralu jezior, są rośliny zanurzone. Poszczególne gatunki roślin, o zróżnicowanej architektonice, stwarzają różne możliwości dla osiadania. Badania prowadzone w kilkudziesięciu jeziorach mazurskich wykazały, że dużo wyższe zagęszczenia postveligerów D. polymorpha notowane były na oślinach wieloletnich w porównaniu z jednorocznymi. Na roślinach wieloletnich osiadłe młode racicznice spotykane były przez cały rok (także zimą pod lodem), natomiast na roślinach jednorocznych występowały tylko tegoroczne postveligery osiadające w środku lata. W odniesieniu do całej populacji D. polymorpha młode osobniki zasiedlające rośliny stanowią zwykle jej dominującą część. W większości badanych jezior mazurskich stanowiły one ponad 85% całej populacji w jeziorze (Lewandowski 1982, 2001). Dorosłe osiadłe na dnie racicznice występują w koloniach lub zwartych ławicach, rzadko jako pojedyncze osobniki. W Europie zagęszczenie wynosi zwykle od kilkuset do kilkunastu tysięcy osobników na 1 m2 dna w strefach występowania. Maksymalne wartości dla Polski stwierdzał Wiktor (1969) w Zalewie Szczecińskim - 114 tys. osobników/m2, przy średnich wartościach ok. 15 tys. osobników/m 2 i biomasie średniej ok. 4,8 kg/m2. W Wielkich Jeziorach Amerykańskich notowano do 700 tys. racicznic na 1 m2 dna (m. in. Nalepa i Schloesser 1993). Długość życia D. polymorpha określana jest zwykle na 3-7 lat. Racicznica jest filtratorem, intensywność filtracji zależna jest głównie od temperatury wody, jakości pokarmu i wielkości małża. Ważne dla racicznic warunki środowiska to odpowiednia trofia i jej zmiany (optymalnie: mezotrofia i umiarkowana eutrofia), umiarkowany ruch wody i odpowiednie trwałe podłoże. W Polsce optymalne środowiska, związane głównie ze strefą przybrzeżną, D. polymorpha znajduje w jeziorach, szczególnie głębszych i niezbyt silnie zeutrofizowanych, w środkowym i dolnym biegu dużych i średnich oraz w dużych nizinnych zbiornikach zaporowych. Osiągane zagęszczenia i biomasa racicznic w różnych typach środowisk są różne - największe w zalewach i jeziorach, mniejsze w zbiornikach zaporowych i rzekach, najmniejsze w niewielkich zbiornikach (np. antropogenicznych). Liczebność niektórych populacji D. polymorpha charakteryzuje się znaczna wieloletnią stabilnością, podczas gdy w innych populacjach obserwowane są gwałtowne jej zmiany. Zmianom ulega również pionowy zasięg występowania i wielkości powierzchni dna zasiedlonej przez małże. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Prawie do końca XVIII w. żywe racicznice stwierdzane były tylko na wybrzeżach mórz Czarnego, Azowskiego i Kaspijskiego. Na innych obszarach znajdowano jedynie okazy kopalne (m.in. Novskij 1960, Nowak 1974). D. polymorpha po raz pierwszy została znaleziona w północnej części Morza Kaspijskiego i w rzece Jaik (obecnie Ural) przez Pallasa w roku 1769 i opisana w dziele "Reise durch verschiedene Provinzen des russischen Reiches" (Pallas 1771).
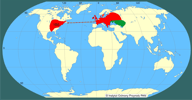
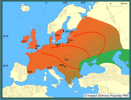
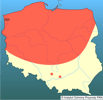
Ekspansja D. polymorpha w końcu XVIII i w XIX w. zachodziła głównie rzekami: od ujścia Wołgi w kierunku północnym i z wybrzeży Morza Czarnego, również na północ, Dnieprem (Nowak 1974). Według Bij de Vaate i in. (2002) bezkręgowce ponto-kaspijskie, m.in. D. polymorpha, przedostały się do Europy rzekami dzięki połączeniu systemów wodnych siecią kanałów (Bij de Vaate i in. 2002). Wyróżnili oni trzy korytarze migracyjne: (1) korytarz północny: Wołga - Jezioro Białe - Onega - Ładoga - Newa - Bałtyk oraz Dniepr - Zalew Kuroński - Bałtyk (via Kanał Ogińskiego i Niemen). Korytarz ten, łączący ważne porty, był wykorzystywany przez D. polymorpha w XVIII w. (Deksbach 1935); (2) korytarz centralny: Dniepr - Wisła - Odra - Łaba - Ren. Szczególne znaczenie miał on do roku 1992. Później, czyli po otwarciu Kanału Men-Dunaj, stracił na znaczeniu, a najważniejszą drogą migracji stał się (3) korytarz południowy łączący Dunaj z Renem. Obecne rozmieszczenie D. polymorpha obejmuje wiele zbiorników i cieków w Europie i w Ameryce Północnej, gdzie przedostała się wraz z wodą balastową statków europejskich w latach 80. XX w. (Hebert P. D. i in. 1989, Lewandowski 1990). Rozszerzanie areału D. polymorpha w Europie, rozpoczęte ok. 200 lat temu, ciągle trwa. Na przełomie XX i XXI w.małże te zostały stwierdzone na zachodzie i południu Europy, w Irlandii, Hiszpanii, środkowych Włoszech, Chorwacji i Bułgarii. W krajach, w których D. polymorpha występuje od dawna, stwierdzane są zmiany w jej rozmieszczeniu - ustępuje w środowiskach o wzrastającej trofii czy przekształconej strefie brzegowej, pojawia się natomiast w zbiornikach antropogenicznych (np. zbiorniki powyrobiskowe), na przykład koło Krakowa, na Śląsku, na Morawach. Charakter rozprzestrzeniania się D. polymorpha może być zarówno naturalny, przy udziale prądów wody i zwierząt, jak i sztuczny, czyli przy udziale człowieka (z jednostkami pływającymi, narzędziami rybackimi i sprzętem sportowym). Rozprzestrzenianie jest najczęściej bierne, a ułatwia je obecność planktonowej larwy oraz osadzającego się na różnych trwałych podłożach postveligera. Według Carltona (1993) D. polymorpha ma dużo większe możliwości rozprzestrzeniania się niż inne mięczaki. Wyróżnia on 23 sposoby przemieszczania drogami naturalnymi i przy udziale człowieka. Znaczenie ekspansji D. polymorpha wiąże się z jej intensywną filtracją wody, udziałem w krążeniem biogenów, zwiększeniem bazy pokarmowej ryb, ptaków i ssaków wodnych oraz obrastaniem przez nią urządzeń hydrotechnicznych. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Na temat pojawiania się D. polymorpha na terenach dzisiejszej Polski istnieją wzmianki rozsiane w różnych pracach. Najstarsze doniesienia o obecności tego małża pochodzą z pierwszej połowy XIX w., ale według Piechockiego i Dyduch-Falniowskiej (1993) z pewnością pojawił się on na tym obszarze zanim rozpoczęto budowę Kanału Augustowskiego (rok 1824). W XIX i XX w. można znaleźć nieliczne wzmianki w publikacjach polskich i niemieckich o pojawianiu się D. polymorpha w jeziorach suwalskich w Kanale Augustowskim, Wiśle i w Zalewie Szczecińskim. Przypuszcza się, że inwazja zachodziła korytarzem północnym i centralnym. Wydaje się, że największy wpływ miały tu niekontrolowane zawleczenia przez człowieka. Piechocki i Dyduch-Falniowska (1993) w największej polskiej monografii poświęconej małżom stwierdzili, że D. polymorpha występuje "głównie na Pojezierzu Mazurskim, na Pomorzu i w Wielkopolsce. Pojedyncze stanowiska znane są też z górnego i środkowego biegu Wisły, górnego biegu Odry i z Beskidu Zachodniego". Dane te przedstawili na tle sytuacji sprzed roku 1950. Dzięki gęstej sieci rzek i kanałów D. polymorpha miała możliwość rozprzestrzeniania się po całym kraju. Zebrane w 2005 roku dane wskazują, że D. polymorpha obecna jest na terenie prawie całej Polski, ale rozmieszczenie jej nie jest równomierne (Stańczykowska i in., w druku). Można wyróżnić trzy strefy charakteryzujące się odmiennym występowaniem racicznicy. Północną - występuje tu ona na największej liczbie stanowisk i osiąga największe liczebności. Jej obecność notowano w Zalewie Szczecińskim i Wiślanym, w dolnym biegu i strefach ujściowych Wisły i Odry, w większości jezior (zwłaszcza przepływowych) głównych pojezierzy: Pomorskiego, Mazurskiego i Suwalskiego oraz w niewielkich czystych rzekach; Centralną - D. polymorpha najliczniej występuje w dużych nizinnych zbiornikach zaporowych na dużych rzekach, w ich strefach ujściowych do zbiorników i w starorzeczach. W zbiornikach na niewielkich rzekach oraz w ich korycie racicznic nie stwierdzono. W jeziorach, nielicznych tu niewielkich pojezierzy D. polymorpha występuje w rzadko i w małych liczebnościach. Południową - D. polymorpha występuje sporadycznie w kilku niewielkich zbiornikach antropogenicznych, w których została zanotowana dopiero w ostatnich latach. | | | | | | Występowanie na terenach chronionych | | D. polymorpha występuje w wodach kilku parków narodowych (np. Słowiński, Wigierski, Woliński), w rezerwatach obejmujących jeziora (np. jez. Dobskie, Hańcza, Gopło, Łuknajno) i niektóre rzeki (np. Krutynia) oraz w licznych parkach krajobrazowych (np. Iński, Mazurski, Nadbużański, Suwalski). | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Masowość występowania D. polymorpha sprawia, że rola tych organizmów w ekosystemach jest istotna. Szczególnie ważna jest jej zdolność do filtrowania znacznych objętości wody. W procesie tym następuje wychwycenie jadalnych cząstek sestonu, a odrzucenie cząstek niejadalnych, uformowanych jako w tzw. pseudofekalia. Przyczynia się to do oczyszczania wody z zawiesiny i ograniczania symptomów eutrofizacji. Znaczna ilość fekaliów i pseudofekaliów opada na dno zbiornika, gdzie tworząc bardzo bogate troficznie środowisko, jest częściowo wykorzystywana jako pokarm przez inne organizmy bentosowe (np. Izvekova i Lvova-Katchanova 1972). W zbiornikach, gdzie populacja racicznicy jest bardzo duża małże te mają teoretycznie możliwość przefiltrowania całej objętości wody w stosunkowo krótkim czasie. Np. w niektórych jeziorach mazurskich mogą one przefiltrować całą wodę w ciągu kilku czy kilkunastu dni, a w Zalewie Szczecińskim w ciągu miesiąca (Wiktor 1969, Stańczykowska 1977). Małże te mają także duże znaczenie w funkcjonowaniu ekosystemów wodnych dzięki kumulacji różnych związków wychwytywanych z przefiltrowanej wody i wbudowywanych w ich ciała i muszle. Są to zarówno biogeny (N i P), jak i metale ciężkie, które w ten sposób usuwane są na pewien czas z obiegu wody (Stańczykowska 1983, Stańczykowska i Lewandowski 1993, Królak 1997). Racicznice stanowią też ważną bazę pokarmową dla wielu gatunków zwierząt. Stadia larwalne są zjadane przez narybek oraz drapieżne skorupiaki planktonowe (Wiktor 1958, Karabin 1978). Osiadłe małże zjadane są głównie przez raki, ryby (płoć Rutilus rutilus, węgorz Anguilla anguilla, leszcz Abramis brama i in.), ptaki (łyska Fulica atra, czernica Aythya fuligula, głowienka Aythya ferina i wiele innych) i ssaki (np. piżmak Ondatra zibethica) związane ze środowiskiem wodnym (m.in. Stempniewicz 1974, Prejs i in. 1990, Molloy i in. 1997). Szczegółowa analiza zawartości przewodów pokarmowych płoci wykazała, że ryby te stosują specjalną strategię odżywiania, wybierając tylko racicznice średniej wielkości, omijając osobniki najmłodsze - (jako "nieopłacalne") i najstarsze - wymagające zbyt dużych nakładów energii na oderwanie od podłoża i zmiażdżenie muszli (Prejs i in. 1990). Presja ptaków na populacje racicznicy w różnych warunkach może być odmienna. Na przykład w jeziorach mazurskich i w Zalewie Zegrzyńskim stwierdzono umiarkowany wpływ ptaków na populacje racicznic. W dużo większym stopniu były one zjadane w jeziorze Gopło. Oszacowano, że w ciągu 9 miesięcy żerowania łysek na tym jeziorze jeden ptak zjadał średnio ponad 20 kg małży, a cała populacja tych ptaków - 3,5 tony, co stanowiło ponad 30%, a w zimie nawet 93% ogólnej biomasy racicznic w badanej części jeziora (Stempniewicz 1974, Mikulski i in. 1975). D. polymorpha tworzy również mikrośrodowiska dla innych małych bezkręgowców oraz przyczynia się do resuspensji osadów dennych. Muszle małży po ich śmierci tworzą usypisko w obrębie sublitoralu stanowiące ponad 90% osadów tej strefy (Lewandowski 2001).
Obecność racicznicy może także wpływać na ptaki wodne. W Jeziorze Genewskim i Bodeńskim, w trzy lata po pojawieniu się w nich D. polymorpha, zaobserwowano wielokrotne zwiększenie się populacji kilku gatunków ptaków, szczególnie w okresie zimowym. W 1971 r. nad samym tylko Jeziorem Bodeńskim populacja każdego z tych gatunków liczyła ponad 30 tysięcy. Prawdopodobnie jest to związane ze znalezieniem przez ptaki lecące jesienią na południowy-zachód, nowego zimowego źródła pokarmu. Do czasu osiedlenia się racicznicy, ptaki te jesienią żywiły się roślinami wodnymi, po obumarciu, których w listopadzie większość z nich odlatywała na południe. Po pojawieniu się racicznicy źródło pokarmu ptaków istnieje przez cały rok, wobec czego zmianie też uległy miejsca żerowania ptaków (Geroudet 1966, Leuzinger i Schuster 1970; Jacoby i Leuzinger 1972). Po masowym wsiedleniu D. polymorpha w roku 1991 do Zatoki Saginaw jeziora Huron, zaobserwowano zmiany zespołów planktonu roślinnego i fauny dennej. Ilość glonów w toni wodnej zmniejszyła się o prawie 60%, stężenie fosforu - o 42%, a tym samym znacznie wzrosła przezroczystość wody. Zmienił się system funkcjonowania całego ekosystemu. Rolę fitoplanktonu jako głównego producenta materii organicznej przejęły glony denne, uległy też przekształceniom kolejne ogniwa łańcucha pokarmowego (Nalepa i Fahnenstiel 1995). W innych Wielkich Jeziorach Amerykańskich bezpośrednio po inwazji racicznicy, stwierdzono również wiele zmian, np. w jakości wody, w składzie ichtiofauny, w składzie pokarmu ryb i w warunkach ich tarlisk. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | D. polymorpha przez masowość występowania może mieć ogromny wpływ na gatunki rodzime, a nawet na całe ekosystemy, co jednak nie musi być jednoznaczne ze "szkodliwością". D. polymorpha często przytwierdza się przy pomocy bisioru do żywych, dużych bezkręgowców, np. muszli mięczaków i pancerzy raków. Szczególnie masowy charakter może to mieć w przypadku małży z rodziny skójkowatych Unionidae (Widuto i Kompowski 1968, Świerczyński 1997, Abraszewska-Kowalczyk 2002. W latach 70. XX w., a więc w okresie kiedy populacja D. polymorpha była w Jeziorze Mikołajskim bardzo obfita, aż 85% badanych Unionidae miało przytwierdzone racicznice. Nie wykazano jednak ich istotnego wpływu na hamowanie wzrostu skójkowatych, choć następuje niekiedy silna deformacja tylnej (syfonowej) części muszli przedstawicieli Unionidae, zwłaszcza cienkościennych szczeżuj Anodonta anatina (Lewandowski 1979). Nie można jednak wykluczyć wpływu D. polymorpha na zanik Unionidae - takie zjawisko obserwowane jest w wielu rzekach i jeziorach Ameryki Północnej, gdzie na skutek wniknięcia i masowego rozwoju D. polymorpha, katastrofalnie zmniejszyła się liczba gatunków i zagęszczenie skójkowatych (np. Hebert i in. 1991, Nalepa i in. 1996, Ricciardi i in. 1996, Hallac i Marsden 2000).
Jako organizm porastający twarde powierzchnie i występujący masowo, D. polymorpha ma w niektórych sytuacjach status gatunku uciążliwego. Szczególnie jest to odczuwalne w systemach hydrotechnicznych związanych z elektrowniami wodnymi (np. na Wołdze, Dnieprze, w rejonie Wielkich Jezior Amerykańskich), w zakładach przemysłowych o wodnym systemie chłodzenia, w systemach melioracyjnych w Ameryce Północnej itp. Niepożądane jest także obrastanie przez D. polymorpha urządzeń portowych, obiektów sportowych i rekreacyjnych. Obrastanie ich przez racicznice powoduje ogromne problemy techniczne i gospodarcze, a nawet całkowicie uniemożliwia ich działanie. Mimo wielu prób i wielkich nakładów finansowych, do chwili obecnej nie udało się ostatecznie rozwiązać tego problemu. W ostatnich latach próbuje się wykorzystać metody oparte na znajomości biologii i ekologii tego małża, polegające zwłaszcza na niszczeniu osadzających się larw. Może to polegać na przeciwdziałaniu wnikania ich do systemu hydrotechnicznego, przeciwdziałaniu osadzania się larw wewnątrz systemu hydrotechnicznego przez tworzenie złych warunków tlenowych, szybkiego przepływu wody lub nieodpowiedniego podłoża lub uśmiercanie larw, które już tam wniknęły poprzez np. chlorowanie czy podgrzewanie wody. Zwalczanie dorosłych małży (metodami chemicznymi, fizycznymi czy mechanicznymi) jest dużo trudniejsze niż usuwanie małych i delikatnych larw. Dlatego też walka z obrastaniem przez D. polymorpha powinna dotyczyć głównie stadiów najmłodszych. W Polsce obrastanie przez racicznice nie powoduje zazwyczaj problemów za wyjątkiem nielicznych urządzeń hydrotechnicznych. | | | | | | Prognoza | | W drugiej połowie XX w. w wielu wodach zaobserwowano zanikanie D. polymorpha z wielu zbiorników, zmniejszanie się obszaru i zasięgu pionowego jej występowania oraz zmniejszanie się liczebności. Zjawiska te związane są przede wszystkim ze wzrostem trofii. Jeżeli zwiększanie się ilości zanieczyszczeń organicznych i wzrost trofii w jeziorach nie zostaną ograniczone, może doprowadzić to do ustępowania z nich racicznicy i to nie tylko w małych i płytkich, ale nawet dużych i głębokich jeziorach. Do zanikania racicznicy może przyczynić się również stałe przekształcanie strefy, gdzie ona występuje (litoral): niszczenie roślinności wodnej, zabudowa brzegów, zrzut ścieków i silne falowanie, spowodowane przez ruch jednostek pływających. Można się też spodziewać poszerzania zasięgu racicznicy na południu Polski i zasiedlania zbiorników antropogenicznych. Trudno natomiast przewidzieć dynamikę rozwoju tych populacji. Obok ustępowania D. polymorpha z różnych środowisk wodnych nie przestaje ona być gatunkiem inwazyjnym i jest możliwość opanowywania przez nią nowych środowisk, zarówno w Polsce, jak i w innych regionach świata półkuli północnej. | | | | | | Literatura | | - Abraszewska-Kowalczyk A. 2002. Unionid bivalves of the Pilica River catchment area. Folia Malacologica 10 (3): 99-173.
- Andrusov N.I. 1897. Iskopaemye i živuščie Dreissenidae Evrazii. Trudy Sankt-Petersburskogo Obščestva Estestvoispytyvanija 25: 1-683.
- Bij de Vaate A., Jazdzewski K., Ketelears H.A.M., Gollasch S., Van der Velde G. 2002. Geographical patterns in range extension of Ponto-Caspian macroinvertebrate species in Europe. Canadian Journal of Fisheries and Aquatic Sciences 59 (7): 1159-1174.
- Carlton I.T. 1993. Dispersal Mechanisms of the Zebra Mussel (Dreissena polymorpha). In: Nalepa T.F., Schloesser D.W. (eds.) Zebra mussels: biology, impacts, and control. Lewis Publishers, Boca Raton, Ann Arbor, London, Tokyo: 677-699.
- Deksbach N.K. 1935. Rasprostranenie Dreissena polymorpha Pall. (Mollusca) v evropejskoj časti SSSR. Biulleten Moskovskogo Obščestva Ispytyvanija Prirody 44: 153-164.
- Geroudet P. 1966. Premieres consequénces ornitologiques de l'introduction de la "moule zébrée" Dreissena polymorpha dans le lac Leman. Nos Oiseaux 28: 301-307.
- Giljarov M.S. 1970. Sposoby rasselenija i tipy razvitija presnovodnych dvustvorčatych molljuskov (Bivalvia). Zoologičeskij Žurnal 49: 621-634.
- Hallac D.E., Marsden J.E. 2000. Differences in tolerance to and recovery from zebra mussel (Dreissena polymorpha) fouling by Elliptio complanata and Lampsilis radiata. Canadian Journal of Zoology 78 (2): 161-166.
- Hebert D.N., Wilson C.C., Murdoch M.H., Lazar R. 1991. Demography and ecological impacts of the invading mollusc Dreissena polymorpha. Canadian Journal of Zoology 69: 405-409.
- Hebert P.D., Muncaster B.W., Mackie G.L. 1989. Ecological and genetic studies on Dreissena polymorpha (Pallas): a new mollusc in the Great Lakes. Canadian Journal of Fisheries and Aquatic Sciences 46: 1587-1591.
- Izvekova E.I., Lvova-Katchanova A.A. 1972. Sedimentation of suspended matter by Dreissena polymorpha Pallas and its subsequent utilization by Chironomidae larvae. Polskie Archiwum Hydrobiologii 19: 203-210.
- Jacoby H., Leuzinger H. 1972. Die Wandermuschel (Dreissena polymorpha) als Nahrung der Wasservögel am Bodensee. Anzeiger der Ornithologischen Gesellschaft in Bayern 11: 26-35.
- Jaeckel S. 1967. Lamellibranchia. In: Illies J. (ed.) Limnofauna europaea. G. Fischer, Jena: 105-109.
- Kačanova A.A. 1961. Nekotorye dannye o razmnoženii Dreissena polymorpha Pallas v Učinskom vodochranilišče. Trudy Vsesojuznogo Gidrobiologičeskogo Obščestva 11: 117-121.
- Karabin A. 1978. The pressure of pelagic predators of the genus Mesocyclops (Copepoda, Crustacea) on small zooplankton. Ekologia Polska 26 (2): 241-257.
- Królak E. 1997. The content of heavy metals in Dreissena polymorpha (Pall.) in lakes Majcz and Inulec, Masurian Lakeland. Polskie Archiwum Hydrobiologii 44: 477-486.
- Leuzinger H., Schuster S. 1970. Auswirkungen der Massenvermehrung der Wandermuschel Dreissena polymorpha auf die Wasservögel des Bodensees. Ornithologische Beobachter 67: 269-274.
- Lewandowski K. 1976. Unionidae as a substratum for Dreissena polymorpha (Pall.). Polskie Archiwum Hydrobiologii 23 (3): 409-420.
- Lewandowski K. 1982. The role of early developmental stages in the dynamics of Dreissena polymorpha (Pall.) (Bivalvia) populations in lakes. II. Settling of larvae and the dynamics of number of sedentary individuals. Ekologia Polska 30 (3/4): 223-286.
- Lewandowski K. 2001. Development of populations of Dreissena polymorpha (Pall.) in lakes. Folia Malacologica 9 (4): 171-216.
- Mikulski J., Adamczak B., Bittel L., Bohr R., Bronisz D., Donderski W., Giziński A., Luścińska M., Rejewski M., Strzelczyk E., Wolnomiejski N., Zawiślak W., Żytkowicz R. 1975. Basic regularities of productive processes in the Iława Lakes and in the Gopło Lake from the point of view of utility values of the water. Polskie Archiwum Hydrobiologii 22 (2): 102-122.
- Molloy D.P., Karatayev A.Y., Burlakova L.E., Kurandina D.P., Laruelle F. 1997. Natural enemies of zebra mussels: predators, parasites, and ecological competitors. Reviews in Fisheries Science 5: 27-97.
- Morduchaj-Boltovskoj F.D. 1965. Proischoždenie i rasprostranenie polimorfnoj drejsseny. W: Soveščanie po biologii drejsseny i zaščite gidrotechničeskich sooruženij ot ee obrastanij. Institut Biologii Vnutrennich Vod, Akademija Nauk SSSR, Togliatti: 3-4.
- Nalepa T.F., Fahnenstiel G.L. (ed.) 1995. Zebra mussels in the Saginaw Bay, Lake Huron ecosystem. Journal of Great Lakes Research 21 (4): 410-573.
- Nalepa T.F., Hartson D.J., Gostenik G.W., Fanslow D.L., Lang G.A. 1996. Changes in the freshwater mussel community of Lake St. Clair: from Unionidae to Dreissena polymorpha in eight years. Journal of Great Lakes Research 22 (2): 354-369.
- Nalepa T.F., Schloesser D.W. (eds) 1993. Zebra mussels: biology, impacts, and control. Lewis Publishers, Boca Raton, Ann Arbor, London, Tokyo: 1-810.
- Novskij V.A. 1960. Nachodka Dreissena polymorpha v četvertičnych slojach Rybinskogo rajona Jaroslavskoj oblasti. Biulleten Instituta Biologii Vodochranilišč 8/9: 28-29.
- Nowak E. 1971. O rozprzestrzenianiu się zwierząt i jego przyczynach. Zeszyty Naukowe, Instytut Ekologii PAN, Warszawa, 3: 1-255.
- Nowak E. 1974. Zwierzęta w ekspansji. Wiedza Powszechna, Warszawa: 1-184.
- Pallas P.S. 1771. Reise durch verschiedene Provinzen des Rußischen Reichs. Erster Thei. Kayserliche Academie der Wissenschaften, St. Petersburg: 1-504.
- Piechocki A., Dyduch-Falniowska A. 1993. Mięczaki (Mollusca), Małże (Bivalvia). Wydawnictwo Naukowe PWN, Warszawa: 1-204.
- Prejs A., Lewandowski K., Stańczykowska-Piotrowska A. 1990. Size-selective predation by roach (Rutilus rutilus) on zebra mussel (Dreissena polymorpha): field studies. Oecologia 83: 378-384.
- Raabe Z. 1956. Badania nad parazytofauną mięczaków słodkowodnych w wodach słonawych. Acta Parasitologica Polonica 4: 375-406.
- Ricciardi A., Whoriskey F.G., Rasmussen J.B. 1996. Impact of the Dreissena invasion on native unionid bivalves in the upper St. Lawrence River. Canadian Journal of Fisheries and Aquatic Sciences 53 (6): 1434-1444.
- Sarnowska K., Lewandowski K. 2003. Maksymalne rozmiary małża racicznica zmienna (Dreissena polymorpha (Pall.) w jeziorach polskich. Przegląd Zoologiczny 47 (1-2): 105-108.
- Shadin W.I. 1935. Über die ökologische und geographische Verbreitung der Sü?wassermollusken in der UdSSR. Zoogeographica 2: 495-554.
- Schröter I. 1779. Die Geschichte der Flusskonchilien mit verzuglicher Rücksicht der decjenigen welche in den Thüringenischen Wasser-Leben. Halle, Bd. Ia: 197-198.
- Sprung M. 1993. The other life: an account of present knowledge of the larval phase of Dreissena polymorpha. In: Nalepa T.F., Schloesser D.W. (eds.) Zebra mussels: biology, impacts, and control. Lewis Publishers, Boca Raton, Ann Arbor, London, Tokyo: 39-53.
- Stańczykowska A. 1977. Ecology of Dreissena polymorpha (Pall.) (Bivalvia) in lakes. Polskie Archiwum Hydrobiologii 24 (4): 461-530.
- Stańczykowska A. 1983. Małże a eutrofizacja wód. Wiadomości Ekologiczne 29: 127-129.
- Stańczykowska A., Lewandowski K. 1993. Effect of filtering activity of Dreissena polymorpha (Pall.) on the nutrient budget in the littoral of Lake Mikołajskie. Hydrobiologia 251: 73-79.
- Stańczykowska A., Lewandowski K., Czarnołęski M. (w druku). Long-term tendencies in populations of Dreissena polymorpha (Pall.) from different habitats in Poland. In: Dreissena polymorpha in Europe. Netherlands.
- Stempniewicz L. 1974. The effect of feeding of coot (Fulica atra L.) on the character of the shoals of Dreissena polymorpha Pall. in the Lake Gopło. Acta Universitatis Nicolae Copernici, Seria Matematyczno-Przyrodnicza 34: 84-103.
- Świerczyński M. 1994. Forma racicznicy zmiennej, Dreissena polymorpha (Pallas, 1771) o zewnętrznej powierzchni barwnej pozbawionej czarnego zygzaka na białorogowym tle. Przegląd Zoologiczny 38: 145-150.
- Świerczyński M. 1997. Occurrence of Dreissena polymorpha (Pall.) in lakes Miedwie and Ińsko. Polskie Archiwum Hydrobiologii 44 (4): 487-503.
- Urbański J. 1957. Krajowe ślimaki i małże. Państwowe Zakłady Wydawnictw Szkolnych, Warszawa: 1-276.
- Wesenberg-Lund C. 1939. Biologie der Süsswassertiere. Springer Verlag, Wien: 1-817.
- Widuto J., Kompowski A. 1968. Badania nad ekologią małżów z rodziny Unionidae w Jeziorze Kortowskim. Zeszyty Naukowe Wyższej Szkoły Rolniczej w Olsztynie 24: 479-497.
- Wiktor J. 1969. Biologia Dreissena polymorpha (Pall.) i jej ekologiczne znaczenie w Zalewie Szczecińskim. Studia i Materiały Morskiego Instytutu Rybackiego, Gdynia A5: 1-88.
- Wiktor K. 1958. Larwy Dreissensia polymorpha Pall. jako pokarm narybku. Przegląd Zoologiczny 2: 182-184.
- Žadin V.I. 1946. Stranstvujuščaja rakuška drejssena. Priroda 5: 29-37.
| | | | | | Streszczenie | | Zebra Mussel is a small fresh and brackish water mussel living in colonies which achieve sometimes very large densities. It attaches itself to hard surfaces by byssal threads. The expansion of this species from the region of the Black, Caspian, and Azow seas to the north and west started on the turn of the 18th century. The species migrated mostly along river channels; it reached the Baltic Sea at the end of the 18th century through the canal connecting the Dniepr and Niemen rivers. In 1824 Zebra Mussel was also noticed in one of the London dockyards. In 1896 it was for the first time described from Szczecin Lagoon. During the whole 20th century Zebra mussel was spreading in Central and Western Europe. In 1985 it started a rapid expansion in North America where it was introduced to one of the Large Lakes probably with balast waters of European ships. Zebra Mussel occurs primarily in the littoral and sublittoral zones of lakes, in middle and lower courses of rivers, in lowland dam-reservoirs. Occurring in masses, D. polymorpha often play an important role in different ecological processes. A positive effect is that Zebra Mussels reduce the suspended organic matter (purification of water from suspended matter), which results in increased water clarity, enrich the diet of many benthophages (birds, fish, crayfish), and enrich the bottom zone in microniches for many invertebrates. A negative impact is that the dense aggregations of zebra mussels settling on hydrotechnic facilities affect their functioning and settling on exposed surfaces of many animal species (particularly other mussels) may contribute to their decline (this concerns e.g. some North American native unionids). | | | | | | Opracowanie | | Anna Stańczykowska i Krzysztof Lewandowski | | | | |
|