
Ameiurus nebulosus (Le Sueur, 1819),
sumik karłowaty
Brown Bullhead |   | Rodzina | | Ictaluridae sumikowate | | Rząd | | Siluriformes sumokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
 | | | | | | Locus typicus/Terra typica | | Jezioro Ontario. | | | | | | Pierwotna ojczyzna gatunku | | Obszar naturalnego występowania znajduje się w Ameryce Północnej. Obejmuje on centralne i wschodnie rejony USA z niemal całym dorzeczem Missisipi i Missouri. Jego północną granicę wyznaczają Wielkie Jeziora i południowo-wschodnia część Kanady (Quebec, Ontario). Na południu sięga po Florydę i Zatokę Meksykańską (Scott i Crossman 1973).
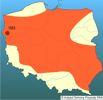
W wyniku zamierzonych lub przypadkowych introdukcji sumik karłowaty wsiedlony został do wielu krajów na terenie Europy, Azji, Ameryki Południowej (Chile), Nowej Zelandii, na Hawaje i Wyspy Karaibskie (Puerto Rico) (Welcomme 1988, Holčík 1991). | | | | | | Podstawowe cechy morfologiczne | | Sumik karłowaty w swojej ojczyźnie dorasta do znacznie większych rozmiarów niż na obszarach, do których został introdukowany. W wodach Florydy osiąga długość ponad 50 cm i masę ciała do 3 kg (Carlander 1969). Na terenie Europy Środkowej przeciętnie dorasta do 20-25 cm i uzyskuje masę 0,25 kg, sporadycznie 30 cm i 0,5 kg. Jego bezłuskie ciało jest w przedniej części, na przekroju poprzecznym, okrągłe, w tylnej, od nasady płetw brzusznych lekko bocznie spłaszczone. Głowa masywna, krótka i szeroka, spłaszczona grzbietobrzusznie. W jej wierzchniej części osadzone są małe oczy. Na szczęce górnej znajdują się dwie pary wąsów. Dłuższe wychodzą z kącika ust i sięgają po nasadę płetw piersiowych. Krótsza para znajduje się przed oczami. Na podbródku występują cztery krótkie wąsy. Linia boczna jest wyraźnie zaznaczona. Biegnie ona pośrodku boków, nie dochodząc do nasady płetwy ogonowej. Płetwy piersiowe są małe, położone tuż za głową. Ich pierwszy promień jest twardy i piłkowany na całej długości. Krótka płetwa grzbietowa przesunięta jest do przodu w stosunku do płetw brzusznych. Jej pierwszy promień jest twardy i piłkowany. Płetwa tłuszczowa jest duża, u starszych osobników zaczyna się kilowatym fałdem tłuszczowym. Płetwa ogonowa zaokrąglona, czasami słabo wykrojona. Płetwa odbytowa jest długa, wsparta na dwóch promieniach twardych i 17-20 miękkich. Ubarwienie głowy, grzbietu oraz górne partie boków są żółtobrązowe; czasami przechodzące w ciemnobrązowe z oliwkowozielonym odcieniem. Na bokach występują jaśniejsze, nieregularne brązowe plamy. Dolne partie boków i brzuch są szarobiałe. W okresie tarła brzuch przybiera żółtawe lub pomarańczowe zabarwienie. Płetwy są tego samego koloru co ciało, ale wyraźnie jaśniejsze. W błonie płetw pomiędzy promieniami znajdują się liczne, drobne ziarna pigmentu. Wąsy na szczęce górnej są ciemnobrązowe lub czarne, a na podbródku jasne - szarobiałe lub żółtawe. Ubarwienie sumika karłowatego w dużym stopniu uzależnione jest od charakteru akwenu i wieku ryb. W płytkich zbiornikach o dnie piaszczystym i gliniastym gatunek ten ma z reguły jaśniejsze ubarwienie. Podobne ubarwienie mają stadia młodociane (Oliva 1950, Frank 1956, Bănărescu 1964, Scott i Crossman 1973, Rolik i Rembiszewski 1987, Movčan 1988, Baruš i Oliva 1995). | | | | | | Biologia, ekologia | | Gatunek ciepłolubny, preferujący zbiorniki wód stojących o miękkim, porośniętym roślinnością dnie, czyli stawy, eutroficzne płytkie jeziora, starorzecza i odcinki wolno płynących nizinnych rzek, ich zatoki oraz kanały. Najchętniej zasiedla strefy płytkiej wody do 1 m głębokości. Rzadko spotykany jest w głębszych partiach (Scott i Crossman 1973, Baruš i Oliva 1995). Sumik jest bardzo odporny na zanieczyszczenia organiczne wody oraz duże wahania pH (3,4-9,1). Znosi okresowe deficyty tlenowe, w tym długotrwałe przyduchy zimowe (Steć 1966, Kornijów 2001). Prowadzi przydenny tryb życia, wykazując wzmożoną aktywność wieczorami i nocą. Należy do oportunistów pokarmowych, choć preferuje pokarm zwierzęcy. Na terenie Europy w okresie młodocianym żywi się głównie zooplanktonem. Starsze osobniki są bentofagami; zjadają larwy owadów: ochotkowatych Chironomidae, ważek Odonata i chruścików Trichoptera, mięczaki Mollusca i skorupiaki wyższe Malacostraca. Chętnie żeruje też na ikrze oraz narybku (Ivlev i Protasov 1948, Frank 1955, Meniuk 1958, Vostradovsky 1958, Hensel 1963, Movčan 1988). W kanale Cisa-Dunaj odnotowano następujące gatunki ryb w diecie sumika karłowatego: ukleja Alburnus alburnus, różanka Rhodeus sericeus, lin Tinca tinca, karaś pospolity Carassius carassius, koza Cobitis taenia i jazgarz Gymnocephalus cernuus (Pupin i Sotirov 1966). W niektórych zbiornikach spektrum pokarmowe wzbogacają komponenty roślinne w postaci glonów nitkowatych (m.in. Spirogyra, Ulotrix, Fragilaria) oraz części makrofitów (Podubsky 1947; Gunn i in. 1977). Dożywa wieku 6-8 lat (Frank 1956, Movčan 1988). W Europie samce i samice dojrzewają w 2-3. roku życia (Balon 1966). Tarło odbywa para, która wcześniej oczyszcza z mułu i roślin piaszczyste dno, tworząc niewielkie zagłębienie, do którego złożona zostaje ikra. Gniazda budowane są w ukryciach - pod brzegami i korzeniami roślin. Tarło przypadające na okres od maja do czerwca rozpoczyna się, gdy woda osiągnie temperaturę 18-20°C. Zazwyczaj jest ono jednorazowe. Płodność jest relatywnie niska i waha się od 1000 do 5000 ziaren ikry. Średnica jaj wynosi 3-4 mm. Długość rozwoju zarodkowego przy temperaturze wody 21-23°C trwa 6-9 dni (Scott i Crossman 1973). Rozwijająca się ikra jest strzeżona przez oboje rodziców, choć samiec wykazuje większy instynkt opieki (Blumer 1985). Opieka ta trwa do rozpoczęcia przez potomstwo samodzielnego żerowania (Oliva 1950). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Sumik karłowaty to popularny gatunek wędkarski w Ameryce Północnej. Do Europy został sprowadzony w celu uatrakcyjnienia łowisk (Witkowski 1989). W początkowym okresie powszechnie uważano, że sprowadzany materiał należy do jednego gatunku - Ameiurus nebulosus, jednak znacznie później okazało się, że w tym samym czasie zostały introdukowane dwa, morfologicznie bardzo podobne do siebie, gatunki z rodzaju Ameiurus: A. nebulosus i A. melas (Wheeler 1978). Po raz pierwszy gatunki te sprowadzono w 1871 r. do wód Francji (Vivier 1951). Później sumiki pojawiły się w Niemczech (1885 r.), Anglii (1885 r.), Holandii (1885 r.), Belgii (1884 r.), Austrii, d. Czechosłowacji (Czechy - 1890 r.; Słowacja - 1926 r.), Finlandii, na Węgrzech (1902 r.), w Irlandii, Polsce (1885 r.), Rumunii, Hiszpanii (1910-1913 r.), d. ZSSR (Białoruś - 1935 r.; Ukraina - 1928 r.), Włoszech, Szwajcarii, Jugosławii (1905 r.) i Norwegii (1890 r.) (Bade 1902, Ivlev i Protasov 1948, Hykeš 1950, Frank 1956, Bănărescu 1964, Bilko i Tortonese 1967, Horoszewicz 1971, Welcomme 1988, Holčik 1991). Współczesne rozsiedlenie A. nebulosus w Europie nie jest dokładnie rozpoznane. W kilku krajach występują obydwaj przedstawiciele tego rodzaju (m.in. Włochy, Węgry, Holandia, Belgia, Niemcy), w niektórych tylko A. melas (Hiszpania, Francja, Wielka Brytania), a w innych - jak Polska, Ukraina, Białoruś czy Finlandia - stwierdzany jest wyłącznie A. nebulosus (Maitland 1977, Wheeler 1978, Elvira 1984, Welcomme 1988, Arnold 1990, De Nie 1996, Keith i Allardi 2001, Reshetnikov 2002, Vasil'eva 2003). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Na teren dzisiejszej Polski w 1885 r. zostało sprowadzonych 50 osobników sumika do stawów w okolicach Barnówka k. Dębna (woj. zachodniopomorskie). Już po pięciu latach gatunek ten osiągnął liczebność ponad 2,5 tys. osobników (Horoszewicz 1971). Pierwsze introdukcje na terenach dzisiejszej Polski zachodniej należy uważać za działanie świadome, wpisujące się w ówczesną modę sprowadzania ryb egzotycznych. Brak jest dokładnych danych dotyczących okresów, w których A. nebulosus pojawił się w poszczególnych regionach Polski. Pax (1925) podaje, że na początku lat XX wieku był już dobrze zadomowiony w wodach Śląska. Na Pojezierze Łęczyńsko-Włodawskie został sprowadzony przed II wojną światową, bowiem wiadomo, że w latach 1935-1937 wsiedlono go do jezior Szackich (Łukie vel Łuki, Lucimierz vel Lucemierz) na ukraińskim obszarze dorzecza Bugu. Stąd systemem kanałów przeniknął do środkowego Bugu i Wieprza. Migrację sumika karłowatego do nowych jezior i cieków ułatwił system Kanału Wieprz-Krzna. Obecnie, poza Bugiem i Wieprzem, jest pospolity w Tyśmienicy, Piwonii, Giełczwi, Śwince oraz licznych jeziorach (m.in. jez. Dratów, Domaszne, Krasne, Uściwierz, Krzczeń, Brzeziczno, Piaseczno) (Adamczyk 1975, Movčan 1988). Ekspansja sumika spowodowana była czynnikami wynikającymi z jego biologii i masowymi translokacjami prowadzonymi przez organizacje wędkarskie, hodowców ryb karpiowatych i prywatne osoby. Znane są przypadki celowego przekształcania łowisk wędkarskich w kierunku zdominowania ich przez ten gatunek (np. żwirownie Januszkowice k. Kędzierzyna-Koźla na początku lat 90. XX w.). Kolejnym czynnikiem sprzyjającym jego ekspansji było stosowanie go jako żywej przynęty (tzw. "żywca") w połowach na ryby drapieżne. Wędkarze zarybiali sumikiem kolejne akweny, uwalniając niewykorzystane ryby w miejscu łowienia lub pozwalając uciec im "z haczyka". Do jego ekspansji przyczyniło się też przypadkowe przenoszenie wraz z materiałem zarybieniowym gatunków gospodarczych (głównie karpiowatych) przez hodowców.
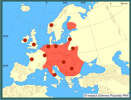
Połączenie systemów rzecznych Europy siecią kanałów żeglugowych i rowów melioracyjnych spowodowało szybkie powiększanie zajmowanego areału przez sumika karłowatego. Obecnie gatunek ten jest szeroko rozsiedlony w wodach Polski; zajmuje Pojezierze Pomorskie, P. Mazurskie, dorzecze Warty (Wielkopolska, Kujawy), środkowe dorzecze Odry (Śląsk) i Wisły (Mazowsze), dorzecze Bugu, Wieprza, dolnego i środkowego Sanu i Pojezierze Łęczyńsko-Włodawskie (Rembiszewski i Rolik 1975, Kolejko 1998, Brylińska 2000). Na niżu Polski jest uważany za gatunek występujący pospolicie. Do niedawna był odnotowywany w 22% polskich rzek (Witkowski 1996). Z danych Kolejko (1998) i Kornijowa (2001) wynika, że w niektórych jeziorach Pojezierza Łęczyńsko-Włodawskiego jego udział w odłowach przekracza 50% masy odławianych ryb, zaś wydajność z 1 ha waha się od 1,1 do 3,7 kg. Podobnie przedstawia się stan populacji tego gatunku w niektórych stawach terenów wodonośnych Wrocławia (Paduszek 1998).
W niektórych regionach Polski obserwuje się zmniejszanie liczebności, a nawet zanik tego gatunku. Potwierdzają to badania monitoringowe prowadzone w latach 1963-1994 w dorzeczu Pilicy. Wykazały one, że w ostatnim okresie sumik nie był już notowany w systemie Czarnej Włoszczowskiej, Luciąży, Czarnej Koneckiej i Drzewiczki, gdzie stwierdzano go w latach poprzedzających badania (Penczak i in. 1995). W połowie ubiegłego stulecia sumik karłowaty był też licznie odławiany w dorzeczu Warty (Jaskowski 1962, Penczak 1969). Szczególnie w starorzeczach wykazywał wysokie wskaźniki stałości występowania i udziału ilościowego w lokalnym rybostanie (np. w starorzeczach Widawki - 49,2%, Pilicy - 20,5%, Pilsi - 10,9%; Penczak 1969a). Ostatnio nie był już notowany w Warcie i jej niektórych dopływach (m.in. Liswarta, Pilsia, Nieciecz; Przybylski i in. 1993, Kruk i in. 2001). Podobnie przedstawia się sytuacja tego gatunku w niektórych rzekach Śląska (Kusznierz i in. 1994). Niewykluczone, że jest to oznaka regresu sumika karłowatego w tych wodach po okresie jego silnej ekspansji. | | | | | | Występowanie na terenach chronionych | | Brak szczegółowych danych. Należy przypuszczać, że jest mieszkańcem większości parków narodowych i krajobrazowych (m.in. Poleskiego PN), z wyjątkiem parków górskich. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Sumik karłowaty konkuruje o pokarm z wieloma gatunkami ryb (Ivlev i Protasov 1948, Frank 1955, Meniuk 1958, Hensel 1963, Movčan 1988). Przez żerowanie na ikrze i narybku bezpośrednio przyczynia się do obniżenia liczebności, a nawet całkowitego zaniku słabszych konkurentów. W akwenach, w których się pojawia (np. Pojezierze Łęczyńsko-Włodawskie) po pewnym czasie staje się dominującym, a czasami jedynym gatunkiem ryby (Danilkiewicz 1973, Adamczyk 1975, Witkowski 1989). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Zgodnie z rozporządzeniem Ministra Rolnictwa i Rozwoju Wsi z dnia 12.11.2001 r. (Dz. U. Nr 138, poz. 1559 z późn. zm.) zakazuje się wpuszczania sumika karłowatego do łowiska, w którym został złowiony oraz do innych wód. W Regulaminie amatorskiego połowu ryb Polskiego Związku Wędkarskiego nie stosuje się dla niego limitów połowowych, ani wymiaru czy okresu ochronnego.
Ze względu na silną inwazyjność sumika należy zalecać szczególną ostrożność przy zarybieniach wód otwartych bądź stawów hodowlanych, aby materiał obsadowy był od niego wolny, zwłaszcza jeśli pochodzi z obszarów aktualnego występowania sumika (Witkowski 2002). Zaniechanie promocji połowów tego gatunku w prasie i publikacjach o tematyce wędkarskiej byłoby czynnikiem wpływającym na zmniejszanie zainteresowania sumikiem karłowatym, a tym samym na jego rozprzestrzenianie. | | | | | | Prognoza | | Sumik karłowaty na stałe zadomowił się w ichtiofaunie Polski i Europy. Tworzy stabilne, samorozradzające się populacje. Przy aktualnym rozsiedleniu i dużej liczebności wyeliminowanie go z wód krajowych wydaje się niemożliwe. Zanik mody na połowy wędkarskie A. nebulosus i akty prawne skierowane na ograniczenie jego ekspansji z pewnością powstrzymują tempo jego dyspersji, jednak nie doprowadzą do eliminacji tego już dobrze zaaklimatyzowanego gatunku w wodach śródlądowych Polski. | | | | | | Literatura | | - Adamczyk L.H. 1975. Sumik karłowaty, Ictalurus nebulosus (Le Sueur), 1819 w biocenozie jeziora. Przegląd Zoologiczny 19: 71-73.
- Arnold A. 1990: Eingebuergerte Fischarten. Zur Biologie and Verbreitung allochtoner Wildfische in Europa. Die Neue Brehm-Buecherei, A. Ziemsen Verlag - Wittenberg Lutherstadt: 76-134.
- Bade E. 1902. Die mitteleuropäischen Sűsswasserfische. 2. Berlin: 1-176.
- Balon E. 1966. Ryby Slovenska. Obzor, Bartislava: 1-413.
- Baruš V., Oliva O. (eds) 1995. Mihulovci - Petromyzontes a ryby - Osteichthyes. 2. Akademia, Praha: 1-698.
- Bănărescu P. 1964. Fauna Republici Populare Romine. Pisces - Osteichthyes. Editura Academiei Republicii Populare Romine, Bucuresti: 1-962.
- Bilko V.P., Pavlov P.I. 1965. Amerikanskij somik Ameiurus nebulosus (Le Sueur) iz Šackoj grupy ozier Vołyni. Materialy Zoologičeskoj Soveščestnosti. Biologičeskije osnovy rekonstrukcji, racjonalnoje ispolzovanje i ochrana fauny južnoj zony evropejskoj časti SSSR, Kišinev: 171-177.
- Blumer L.S. 1985. Reproductive natural history of the brown bullhead, Ictalurus nebulosus. Environmental Biology of Fishes 12: 231-236.
- Brylińska M. (red.) 2000. Ryby słodkowodne Polski. Państwowe Wydawnictwo Naukowe, Warszawa: 1-524.
- Carlander K.D. 1969. Handbook of freshwater fishery biology. 1. Life history data on freshwater fishes of the United States and Canada, exclusive of the Perciformes. Iowa State University Press, Ames: 1-752.
- Danilkiewicz Z. 1973. Ichtiofauna dorzeczy Tyśmienicy i Włodawki. Fragmenta Faunistica 19: 121-147.
- De Nie H.W. 1996. Atlas van de Nederlandse Zoetwatervissen. Media Publishing, Doetinchem: 1-151.
- Elvira B. 1984. First records of the North American catfish Ictalurus melas (Rafinesque, 1820) (Pisces, Ictaluridae) in Spanish waters. Cybium 8: 96-98.
- Frank S. 1955. Potravni biologie sumečka amerického (Ameiurus nebulosus Le Sueur, 1819) v Polabi. Acta Universitatis Carolinae Biologica 1: 19-24.
- Frank S. 1956. Sumeček americký (Ameiurus nebulosus Le Sueur, 1819) v našich vodach. Časopis Narodneho Musea, Praha, 125, 1: 35-47.
- Gunn J.M., Quadri S.U., Mortimer D.C. 1977. Filamentous algae as a food source for the brown bullhead (Ictalurus nebulosus). Journal of the Fisheries Research Board of Canada 34: 396-401.
- Hensel K. 1963. Nahrungsbiologie des Zwergwelses (Ameiurus nebulosus Le Sueur, 1819) in einigen Koleen der mittleren Elbe der Tschechoslowakei und Bemerkungen űber seine Konkurrenzbeziehungen zu anderen Fischen. Zeitschrift für Fischerei 11: 715-733.
- Holčik J. 1991. Fish introductions in Europe with particular reference to its Central and Eastern part. Canadian Journal of Fisheries and Aquatic Sciences 48: 13-23.
- Horoszewicz L. 1971. Sum. Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa: 1-191.
- Hykeš O.V. 1950. Zpravy. Akvaristicke Listy 22: 85.
- Ivlev V.S., Protasov A.A. 1948. Amerikanskij som v ozierach Vołynskoj oblasti. Priroda 8: 67-68.
- Jaskowski J. 1962. Materiały do znajomości ichtiofauny Warty i jej dopływów. Fragmenta Faunistica 9: 449-499.
- Keith P., Allardi J. 2001. Atlas des poissons d'eau douce de France. Patrimoines Naturels 47, Paris: 1-387.
- Kolejko M. 1998. Sumik karłowaty (Ictalurus nebulosus Le Sueur) w wodach Pojezierza Łęczyńsko-Włodawskiego. Przegląd Rybacki 4: 19-22.
- Kornijów R. 2001. Przyczyny sukcesu kolonizacyjnego sumika karłowatego Ictalurus nebulosus Le Sueur, 1819 w ekosystemach wodnych Polski. Przegląd Zoologiczny 45: 113-119.
- Kruk A., Penczak T., Przybylski M. 2001. Wieloletnie zmiany w ichtiofaunie górnego biegu Warty. Roczniki Naukowe Polskiego Związku Wędkarskiego 14 (suppl.): 189-211.
- Kusznierz J., Witkowski A., Kotusz J., Błachuta J. 1994. Ichtiofauna dorzeczy Stobrawy i Smotrawy. Roczniki Naukowe Polskiego Związku Wędkarskiego 7: 51-70.
- Maitland P.S. 1977. Freshwater fishes of Britain and Europe. Hamlyn, London: 1-256.
- Meniuk N.S. 1958. Pitanje ryb v ozerach Svitjaz, Pulemienckoje, Ljucimer Vołynskoj oblasti. Trudy Naučno Isledovatilnogo Instituta Rybnogo Choziajstva 11: 133-155.
- Movčan Y.V. 1988. Fauna Ukrainy. 8 Ryby. 3. Naukova Dumka, Kijev: 1-367.
- Oliva O. 1950. Sumeček americký (Ameiurus nebulosus Le Sueur 1819). Akvaristicke Listy 22: 74-75.
- Paduszek D. 1998. Biometria Ictalurus nebulosus (Le Sueur, 1819) z terenów wodonośnych Wrocławia. Muzeum Przyrodnicze, Uniwersytet Wrocławski, Wrocław: 1-24.
- Pax F. 1925. Wirbeltierfauna von Schlesien. Faunistische und tiergeographische Untersuchungen im Odergebiet. 5. Pisces. Verlag von Gebrueder Borntraeger., Berlin: 516-537.
- Penczak T. 1969a. Ichtiofauna rzek Wyżyny Łódzkiej i terenów przyległych. Część I c. Hydrografia i rybostan Warty i dopływów. Acta Hydrobiologica 11: 69-118.
- Penczak T. 1969b. Ichtiofauna rzek Wyżyny Łódzkiej i terenów przyległych. Część III. Przegląd i charakterystyka gatunków. Acta Hydrobiologica 11: 339-360.
- Penczak T., Zaczyński A., Marszał L., Koszaliński H. 1995. Monitoring ichtiofauny dorzecza Pilicy. Roczniki Naukowe Polskiego Związku Wędkarskiego 8: 5-53.
- Podubsky V. 1947. Zkušenosti se sumečkem americkym. Československe Rybarstvi 2: 48-48.
- Przybylski M., Frankiewicz P., Bańbura J. 1993. Ichtiofauna dorzecza górnej Warty. Roczniki Naukowe Polskiego Związku Wędkarskiego 6: 49-78.
- Pujin V., Sotirov S. 1966. Prilog proučavanju ishrane patuljastog (Ictalurus nebulosus). Letopis Naučnogo Radova 10: 147-156.
- Reshetnikov J.S. (ed.) 2002. Atlas presnowodnych ryb Rossiji. Tom 2. Nauka, Moskwa: 1-256.
- Rolik H., Rembiszewski J.M. 1987. Fauna słodkowodna Polski. Zeszyt 5: Ryby i krągłouste (Pisces et Cyclostomata). Państwowe Wydawnictwo Naukowe, Warszawa: 1-317.
- Scott W.B., Crossman E.J. 1973. Freshwater fishes of Canada. Bulletin. Fisheries Research Board of Canada, Ottawa 184: 1-966.
- Steć J. 1966. Ichtiofauna zbiorników wodnych okolic Rejowca. Annales Universitatis Mariae Curie-Skłodowska C, 21: 131-141.
- Tortonese E. 1967. Il pesce gatto. Rivista Italiana di Piscicultura e Ittiopatologia 2: 46-47.
- Vasil'eva E.D. 2003. Main alterations in ichthyofauna of the largest rivers of the northern coast of the Black Sea in the last 50 years: A review. Folia Zoologica 52 (4): 337-358.
- Vivier P. 1951. Poissons et crustacés d'eau douce acclimatés en France en eaux libres depuis le début du siecle. Terre Vie 98: 57-82.
- Vostradovsky J. 1958. K biologii a hospodarskemu vyznamu sumečka americkeho Ameiurus nebulosus Le Sueur, 1819 v našich vodach. Živocisna Vyroba 31: 321-332.
- Welcomme R.L. 1988. International introductions of inland aquatic species. Fisheries Technical Paper 294: 1-318.
- Wheeler A. 1978. Ictalurus melas (Rafinesque, 1820) and I. nebulosus (Lesuer, 1819): the North American catfishes in Europe. Journal of Fish Biology 12: 435-440.
- Witkowski A. 1989. Introdukowane ryby w polskich wodach i ich wpływ na środowisko. Przegląd Zoologiczny 33: 581-598.
- Witkowski A.1996. Introduced fish species in Poland: pros and cons. Archives of Polish Fisheries 4 (1): 101-112.
- Witkowski A. 2002. Introduction of fishes into Poland: benefaction or plague? Nature Conservation 59: 41-52.
| | | | | | Streszczenie | | The species originated in North America. The areas of its natural occurrence are the eastern and central parts of this continent. Brown Bullhead was introduced to Europe in the later part of the 19th century to make angling grounds more attractive. In the contemporary area of Poland it is ponds in the environs of Dębno (Western Pomerania) which were first stocked with Brown Bullhead in 1885. Further translocations by angling associations and fish-farmers (mainly carp-farmers) and biological predisposition of this species to spread (ability to migrate via the system of canals connecting drainage basins and supplant competing species in new habitats) caused the quick expansion of Brown Bullhead almost throughout Poland. Habitats of the species are stagnant or slowly flowing waters with soft bottoms overgrown by vegetation: ponds, shallow eutrophic lakes, ox-bow lakes, slow current stretches of rivers, inlets and canals. The successful invasion of that species was facilitated by such characteristics of its biology as tolerance to short-term oxygen deficit, food opportunism, parental care for offspring, and predation on the spawn and juvenile stages of fish with overlapping ecological niches. Predation and competition for environmental resources with many fish species are the most important negative effects of Brown Bullhead occurrence on native ecosystems. Currently it is a well-acclimatized and common element of the freshwater ichthyofauna of Poland. | | | | | | Opracowanie | | Jan Kotusz | | | | |
|