
Craspedacusta sowerbii Lankester, 1880
słodkowodna meduzka
Freshwater Jellyfish |   | Rodzina | | Olindiidae | | Rząd | | Hydrozoa stułbiopławy | | Gromada | | Cnidaria | | Typ | | Ctenophora parzydełkowce | | |
 | |  | | | | | | | | |
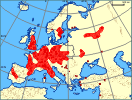
 | | | | | | Pierwotna ojczyzna gatunku | | Rejon pontokaspijski Istnieją cztery poglądy odnośnie pochodzenia tego gatunku: (1) ekspansja Craspedacusta sowerbii nastąpiła z Brazylii wraz z rośliną wodną Victora regia (syn. V. amazonica) via ogród botaniczny w Regent's Park w Londynie (Lankester 1880); (2) jej ojczyzną są Chiny, jako że w chińskich dokumentach opisano ją już w roku 1250; (3) gatunek rozprzestrzenił się w wodach słodkich w okresie późnego karbonu lub później, kiedy to ocean Tetydy oblewał Pangeę, później oddzielał Laurazję od Gondwany, wreszcie Afrykę od Eurazji (Zienkiewicz 1940; Reisinger 1972). (4) Dziś przeważa pogląd , że ojczyzną tego gatunku jest region pontokaspijski, z którego gatunek opanował Europę i Azję (Jankowski i in. 2008). Ta ostatnia hipoteza nie wyjaśnia jednak występowania C. sowerbii na półkuli południowej, np. w Australii i Nowej Zelandii (Żurek 2010). | | | | | | Podstawowe cechy morfologiczne | | W stadium polipa gatunek osiadły, tworzący małe płożące się kolonie osobników. Polipy (hydranty) pozbawione są czułków, mają kształt cylindryczny, apikalną gębę (stożek gębowy hypostomum) z otworem gębowym pełniącym jednocześnie funkcję otworu odbytowego. Dolna część ciała różnicuje się w tzw. stopę. Polipy rozmnażają się bezpłciowo przez frustule, czyli odrywające się części ciała, orzęsione i zdolne do ruchu.
Meduzy mają kształt dzwonu, dorosłe osobniki osiągają średnicę 10-20 mm. Powstają z polipów drogą pączkowania, odrywając się od osobnika rozrodczego. Meduzy - w przeciwieństwie do polipów - pływają wolno, posiadają trzy zestawy czułków różnej długości. Krótsze służą do chwytania pokarmu, a dłuższe do stabilizacji w czasie pływania i polowania. Liczba czułków rośnie z wiekiem i dojrzałością meduzy. Ich liczbę różni autorzy podają w zakresie od 218 (Pérez-Bote i in. 2006) do 497 (Boothroyd i in. 2002).
Zawartość wody w ciele C. sowerbii wynosi 96,7 - 99,87 %. Biomasa osobnika waha się od 0,06 do 331,86 mg/osobn., zaś sucha masa zwykle 0,01 do 2,50 mg (Jankowski 2000).
| | | | | | Biologia, ekologia | | Craspedacusta sowerbii jest eurybiontem. Występuje w strefie umiarkowanej obu półkul. Z Europy znana z wielu stanowisk. Preferuje wody stojące i wolno płynące. Spotyka się ją w zbiornikach zimnych i ciepłych, jeziorach, żwirowniach, wyrobiskach piasku, zatopionych kamieniołomach, w rzekach, kanałach, kanałach zrzutowych elektrowni (np. w Czarnobylu). Jej pojawianie się jest nieprzewidywalne. Stadia przetrwalnikowe są wieloletnie, odporne na niepomyślne warunki. Wyschnięte cysty Craspedacusta mogą przeżyć 40 lat (Bouillon i in. 2004). Nieznany jest impuls powodujący powstawanie meduz.
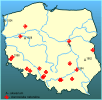
Dojrzałość płciową meduzy osiągają po 5-6 tygodniach. Populacje meduz są zwykle jednopłciowe, tworzą je albo same samice, albo same samce. Jako optimum termiczne różni autorzy podają 19-25oC, ale spotykano też meduzy w temperaturze powyżej 30 oC. Wang i in. (2006) za temperatury optymalne uważają zakres 15?20 ?C , a pH w granicach 6,9?8,2. Dla polipów optymalne temperatury są niższe, a przy 30?C giną (Acker i Muscat 1976). Meduzy są spotykane w porze letniej najczęściej w sierpniu i wrześniu. Żyją od 34 do 51 dni. Są dość odporne na niedotlenienie - giną w koncentracji tlenu 0,26 mg dm-3 (Wang i in. 2006). Odbywają migracje dobowe: w ciągu dnia meduzy chowają się w głębszych warstwach wody, a w nocy podpływają pod powierzchnię. Ich ofiarami są zwierzęta planktonowe i bentosowe o rozmiarach od 0,1 do 3,0 mm. Najefektywniej polują na zwierzęta wielkości 0,4 - 1,4 mm i aktywne, jak np. widłonogi. Rzadko pobierają zwierzęta większe. Prawie nigdy nie zjadają drobnych i dobrze opancerzonych wrotków (np. Keratella cochlearis). Przy zagęszczeniu planktonu około 100 osobników w litrze meduza zjada 190 zwierząt planktonowych dziennie. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Nieznane. Pierwsze obserwacje z roku 1924 i 1928 są obserwacjami akwariowymi. Warto zauważyć, że w tym samym roku, kiedy znaleziono meduzę w kanale Exeter (1928 i 1929 r.; Valentin 1930), stwierdzono ją w akwarium w zachodniej Polsce (Maske 1928), a osiem lat wcześniej w Berlinie (Roch 1924; Moser 1930). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Najstarsze informacje o wykryciu meduz w Polsce pochodzą z hodowli akwariowych z 1924 i 1928 roku. Pierwsza obserwacja pochodzi z akwarium w Szczecinie (Broch 1928), późniejsza zaś od Maske (1928) z akwarium szkolnego w Szamotułach. Sembrat (1935) podaje informację o znalezieniu meduz w akwariach w Warszawie. Bielak i Gieryng (1965) w roku 1962 młodociane meduzy znaleźli w akwarium w Lublinie. Nie udało się jednak ustalić skąd mogły zostać zawleczone. Udało się natomiast ustalić miejsce pochodzenia polipów z warszawskiej hodowli akwariowej Borysa Wasiuka, który w 2009 r. (inf. ustna) pobrał je wraz z mułem i wodą ze stawku przy szosie Lublin-Warszawa. Wcześniej jednak, w 1994 r. masowe pojawy tego stułbiopława odkryto w naturalnych zbiornikach wodnych na Wiśle k. Tarnobrzega, a w 1998 r. także w niewielkim zbiorniku w m. Świętoszów k. Żagania (Wiktor i Witkowski 1999). Z czasem kilka dalszych, nie zawsze publikowanych stanowisk tego gatunku odnotowano w różnych częściach Polski. Były to obserwacje głównie płetwonurków i wędkarzy otrzymane przez autora w zwracanych ankietach. | | | | | | Występowanie na terenach chronionych | | Gatunek zwykle pojawia się w zbiornikach sztucznych, takich jak zatopiony kamieniołom, wyrobisko piasku, żwiru. Bywa spotykany dużych, wolno płynących rzekach. Zwykle nie są to akweny chronione. Całymi latami osobniki mogą żyć w postaci polipów przy pełnej niewiedzy ludzi i mogą być znajdowane tylko przypadkowo. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Ze względu na rzadkość występowania, wpływ meduz w polskiej przyrodzie jest na razie nieistotny. Oddziaływanie polipów na zooplankton jest tu trudne do oceny z powodu braku takich badań. Niewątpliwie polipy Craspedacusta wspólnie ze stułbiami Hydra sp. i mszywiołami Bryozoa skracają obieg materii w ekosystemach wodnych. Obserwacje prowadzone na polipach i wylęgu skalnika prążkowanego Morone saxatilis dowodzą możliwości żerowania polipów na młodych skalnikach. Teoretycznie mogą stanowić zagrożenie dla wylęgu ryb. Są konsumentami drugiego rzędu. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Gatunek drapieżny, zarówno w stadium polipa jak i meduzy. Okresowo przy masowym występowaniu obniża liczebność planktonu skorupiakowego, czyli wydajnych filtratorów. Z tego względu może przyspieszać występowanie zakwitów glonów w zbiornikach. Z powodu krótkiego okresu występowania meduz - około 1 miesiąca - zagrożenie takie jest raczej teoretyczne. Realne jest zagrożenie poparzenia kąpiących się ludzi. Zdarzenie takie miało miejsce w Krakowie na kąpielisku Bagry. Meduzy pojawiają się zwykle od lipca do początku września, kiedy temperatura wody jest dość wysoka.
Gatunek jest rzadki, występuje niespodziewanie, krótko i w nieprzewidywalnych miejscach. Nie ma potrzeby zwalczania go.
| | | | | | Prognoza | | Stan polskiej populacji wydaje się stabilny od 80 lat, jakkolwiek lista obserwowanych stanowisk będzie się prawdopodobnie zwiększała wraz ze wzrostem turystycznej aktywności społeczeństwa i związanej z tym penetracji różnych zbiorników wodnych. O ile pierwsze odkrycia zawdzięczamy akwarystom, to obecne płetwonurkom i plażowiczom. | | | | | | Literatura | | - Acker T.S., Muscat A.M. 1976. The Ecology of Craspedacusta sowerbii Lankester, a freshwater hydrozoan. The American Midland Naturalist 95(2): 323-336.
- Bielak T., Gieryng R. 1965 Mało znana w faunie Polski meduza słodkowodna Craspedacusta sowerbyi Lankester (Hydrozoa) [Freshwater jelly-fish Craspedacusta sowerbyi Lankester (Hydrozoa) rarely reported in the fauna of Poland. Przegląd Zoologiczny 9: 158-160.
- Boothroyd I.K.G., Etheredge M.K., Green J.D. 2002. Spatial distribution, size structure, and prey of Craspedacusta sowerbyi Lankester in a shallow New Zealand lake. Hydrobiologia 468: 23–32.
- Broch H. 1928. Die Tierwelt Deutschlands 4. Jena: 95-160.
- Bouillon J., Medel M.D., Pagès F., Gili J.M., Boero F., Gravili C. 2004 Fauna of the Mediterranean Hydrozoa. SCI. MAR., 68 (Suppl. 2): 5-438.
- Jankowski T. 2000. Chemical composition and biomass parameters of a population of Craspedacusta sowerbii Lank1880 (Cnidaria: Limnomedusa). J. Plankton Res. 22, 7: 1329–1340.
- Jankowski T., Collins A.G., Campbell R. 2008. Global diversity of inland water cnidarians. Hydrobiologia 598: 35-40.
- Lankester E.R. 1880. On Limnocodium (Craspedacusta) sowerbii, a new Trachomedusa inhabiting freshwater. Quarterly Journal of Microscope Science 20: 351-371.
- Maske B. 1928. Nieznany we faunie Polski rodzaj jamochłona Microhydra ryderi Potts. (Un Coelentaré inconnu en Pologne Microhydra ryderi Potts). Kosmos ser. A, 53: 83-85.
- Moser J. 1930. Microhydra E. Potts. Sitzungsber. Ges. Naturf. Freunde., Berlin.
- Pérez-Bote J.L., Muñoz A., Morán R., Roso R., Romero A.J. 2006. First record of Craspedacusta sowerbyi Lankester, 1880 (Cnidaria: Limnomedusae: Olindiidae) in the Proserpina Reservoir (Extremadura, SW Spain) with notes on their feeding habits. Belg. J. Zool. 136: 163-166.
- Reisinger E. 1972. Süsswassermedusen. In : Elster H.J., Ohle W. (eds.) Das Zooplankton der Binnengewässer 26, Part 1, Stuttgart: 84-98.
- Roch F. 1924. Microhydra germanica - die deutsche Süßwassermeduse. Bl. f. Aquar. Terr. Kde., 36: 205-208.
- Sembrat K. 1935. O słodkowodnej meduzie Craspedacusta. Przyroda i technika. Lwów-Warszawa 14: 344-350.
- Valentin R. 1930. Craspedacusta (Limnocodium) sowerbii in the Exeter ship canal. Nature 125: 15-16.
- Wang D.L., Xu S.L., Jiang H.L., Yang H. 2006. Tolerance of Craspedacusta sowerbyi xinyangensis to the stresses of some ecological factors. J. Appl. Ecology 17, 6: 1103-1106.
- Wiktor A., Witkowski A. 1999. Masowy pojaw słodkowodnej meduzy Craspedacusta soverbyi (Lancester, 1880) (Coelenterata, Hydrozoa). Mass occurrence of a jelly-fish, Craspedecusta sowerbyi (Lankester, 1880) (Cnidaria: Hydrozoa). Przegląd Zoologiczny 43: 89-93.
- Zienkiewicz L.A. 1940 Rasprostranenie presnovodnykh i slonovatovodnykh kishechnopolostnykh. [The Distribution of Fresh- and Brackish-water Coelenterata]. Zool. Zhurnal 19: 580-602.
- Żurek R. (2010). Craspedacusta sowerbii Lankester, 1880 – słodkowodna meduza. Cz.1. Historia odkrycia, rozmieszczenie I systematyka meduz słodkowodnych. Chrońmy Przyr. Ojcz. 66, 5: 391-396.
| | | | | | Streszczenie | | The medusa stage of this species was described by Lankester in 1880 for specimens found in Regent's Park in London. Since 1924 it is know that earlier described polyp of Microhydra ryderi is the polyp stage of Craspedacusta sowerbii. From Poland is known since 1924 (at Szczecin) and 1928 (aquarium at Szamotuły, central Poland). In Poland, this species was observed behind groynes of Wisła near Tarnobrzeg, (1994), small gravel-pit at Świętoszów (1998), Srebrne lake near Osowiec (2006), Rórzyca River (2001), Bagry gravel pit in Kraków (2002, 2009) quarry 'Pist' (2007, 2008), pond at Grabowiec (2008), pond at Trzebień (2008), sand-pit 'Piachy' in Starachowice (2007), pond at Wilków (2009) and in few towns in aquaria both as polyps and medusa. Almost every year is observed in Srebrne Lake near Opole. It is eurybiontic species. Observed in some other regions of Poland. Occurs in temperate zone of both hemispheres. From Europe is know from numerous sites. It prefers stagnant waters or slowly flowing. Usually is noted from artificial reservoirs: quarries, sand-pits, gravel-pits, ponds, rarely in rivers. Its appearance is unforeseeable. The resting stages are able to survive many years during unfavourable periods. Species come to Poland from Caspian sea region or was brought with exotic water plants from South America via England. Species predacious, both in polyp stage as well as in medusa stadium. The prey of medusae and polyps are small planktonic and benthic animals of 0.1 to 3.0 mm in size. Life span is 34 to 51 days. They are relatively resistant on hypoxia, perish at 0,26 mg dm-3 of oxygen. They have diel vertical migrations - during the day hides at deeper layers whereas in the night migrate toward the surface. During the mass appearance, usually in August, can be danger for bathers. There is no need of species control. | | | | | | Opracowanie | | Roman Żurek | | | | |
|