
Ondatra zibethicus (Linnaeus, 1766)
piżmak
Muskrat |   | Rodzina | | Arvicolidae nornikowate | | Rząd | | Rodentia gryzonie | | Gromada | | Mammalia ssaki | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
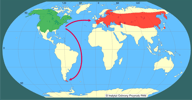
 | | | | | | Pierwotna ojczyzna gatunku | | Zasięg naturalnego występowania gatunku obejmował prawie całą Amerykę Północną: od koła podbiegunowego po Zatokę Meksykańską (Willner i in. 1980). | | | | | | Podstawowe cechy morfologiczne | | Piżmak jest dość dużym gryzoniem o krępej budowie ciała. Głowa stosunkowo duża, uszy prawie niewidoczne, pysk tępo zakończony. Ogon jest bocznie spłaszczony, pokryty łuskowatą skórą. Przednie kończyny są bardzo sprawne i chwytne, natomiast tylne są mocniejsze i służą do pływania (ich długie palce nie są spięte błoną pławną, tylko po obu stronach mają gęste, szczeciniaste włosy). Brak dymorfizmu płciowego, natomiast istnieje duża zmienność wymiarów i masy ciała między piżmakami z różnych części geograficznego zasięgu gatunku. Masa ciała dorosłych osobników wynosi 0,7-1,8 kg, długość ciała 27-35 cm, a długość ogona 20-28 cm (Ruprecht 1974, Willner i in. 1980). Całe ciało piżmaka, z wyjątkiem palców kończyn i ogona, pokryte jest gęstym futrem, które więzi w sobie pęcherzyki powietrza, przez co futro jest wodoodporne. Ubarwienie ciała wykazuje znaczną zmienność geograficzną i indywidualną, zwykle na grzbiecie i głowie futro jest ciemnobrunatne, a na stronie brzusznej szarordzawe. | | | | | | Biologia, ekologia | | Piżmaki prowadzą ziemno-wodny tryb życia: zasiedlają brzegi jezior i rzek, bagna, rozlewiska i kanały melioracyjne. Preferują miejsca z bogatą roślinnością wodną. Gryzonie te kopią nory w brzegach lub budują na wodzie chatki z materiału roślinnego (Danell 1978). Nory (o średnicy 13-15 cm i długości do 13 m) mają wejście pod wodą i wiodą do komory powyżej poziomu wody (Connors i in. 2000). Chatki w formie kopczyków z materiału roślinnego i błota (nawet do 1,8 m średnicy i 1,5 m wysokości nad poziom wody) budowane są na twardym podłożu, a do ich wnętrza prowadzą podwodne wejścia (Errington 1963). Piżmaki są aktywne w ciągu całej doby, ale szczyt aktywności przypada na okres od popołudnia do świtu (Stewart i Bider 1974, Brooks 1985). Gryzonie te żywią się roślinami wodnymi (zwłaszcza pałką wodną, sitowiami, skrzypami i rdestnicami), turzycami i wierzbami oraz roślinami uprawnymi. Kiedy pokarm roślinny jest trudno dostępny, zjadają także mięczaki, skorupiaki, żaby i ryby (Willner i in. 1980). Piżmaki żyją w dużych grupach rodzinnych w ramach określonych terytoriów (Neal 1968, Vincent i Quéré 1972), których wielkość rzadko dochodzi do kilku hektarów. Zagęszczenie piżmaków w najlepszych siedliskach może osiągać nawet do 600 osobników na hektar (MacArthur 1978; Proulx i Gilbert 1983). Piżmaki są poligamiczne, poszczególne osobniki mogą kojarzyć się z wieloma partnerami. Samice mają do kilku miotów (o liczebności 5-10 młodych) w ciągu roku. Potomstwo usamodzielnia się w wieku 3-4 tygodni i osiąga dojrzałość płciową w wieku 7-12 miesięcy (Errington 1963, Baker 1983, Boutin 1987). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | W 1905 roku hrabia Colloredo-Mannsfeld wypuścił 5 osobników (2 samce i 3 samice) na stawach rybnych w miejscowości Staré Huti u Dobříše (zachodnie Czechy). Zwierzęta te znalazły tam idealne warunki bytowania i nastąpiła niezwykle szybka ekspansja populacji piżmaka we wszystkich kierunkach z szybkością około 25 km rocznie (Nowak 1971). Oprócz tego, że piżmaki aktywnie przemieszczają się w poszukiwaniu nowych siedlisk, potrafią także szybko migrować na duże odległości (do 160 km dziennie) wykorzystując unoszenie przez prądy wodne w rzekach (Böhmer i in. 2001). W 1914 r. piżmaki osiągnęły Niemcy i prawdopodobnie w tym samym czasie Austrię, w 1915 r. Węgry, w 1924 r. Polskę, w 1932 r. Jugosławię i w 1942 r. Rumunię.
Gatunek ten uważany był za cenne zwierzę futerkowe, dlatego też w początkach XX wieku zakładano liczne fermy (Francja i Belgia). Ucieczki zwierząt z ferm stanowiły istotne źródło dla stworzenia wolno żyjących populacji. Dodatkowo prowadzone były celowe introdukcje tego gatunku (np. Finlandia), ale przodował w tym dawny Związek Radziecki, w którym od 1928 roku dokonano ponad 3 000 wsiedleń, a liczba wypuszczonych zwierząt przewyższała 300 000 (Chashchukhin 1987).
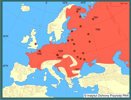
Obecnie piżmak występuje powszechnie w zachodniej, centralnej i północno-wschodniej części kontynentu europejskiego (Zima 1999). W Rosji piżmak zasiedla obecnie wszystkie wody z wyjątkiem obszarów w strefie arktycznej i pustynnej (Amirkhanov 1997). Nie bytuje na Wyspach Brytyjskich - został tam skutecznie wytępiony w latach 30. XX wieku (Gosling i Baker 1989). W wyniku introdukcji piżmak występuje także szeroko w północnej i wschodniej Azji oraz lokalnie w Ameryce Południowej (Willner i in. 1980). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Piżmak przedostał się do Polski dwoma drogami: przez naturalne rozprzestrzenienie się z Czech (miało to zasadnicze znaczenie dla zasiedlenia obszaru naszego kraju) oraz przez sprowadzanie do ferm hodowlanych, skąd nierzadko wydostawał się na wolność (Nowak 1966). We współczesnych granicach Polski piżmak pojawił się w 1924 roku, najprawdopodobniej przedostając się z Czech doliną rzeki Orlicy w okolice Bystrzycy Kłodzkiej, a być może także w okolicy Przełęczy Lubawskiej, a stamtąd dopiero do Odry, po czym zarówno w górę, jak i w dół tej rzeki (Nowak 1966). Hodowla fermowa piżmaków rozpoczęła się w Polsce w drugiej połowie lat 20. XX w. i rozwinęła się bardziej z początkiem lat 30. tegoż wieku. Brak jest kompletnych informacji o lokalizacjach tych ferm, ale udało się zebrać dane o tych największych (Nowak 1966). Większość hodowli tych gryzoni zlikwidowano po wydaniu w 1934 roku zarządzenia nakazującego budowę kosztownych urządzeń zabezpieczających przed ucieczkami zwierząt. Po tym okresie proces rozprzestrzeniania się piżmaka przebiegał więc z pewnością na drodze naturalnej i był jedynie hamowany przez intensywne tępienie tego gryzonia. Okres II wojny światowej sprzyjał szybkiej ekspansji piżmaka, tak, że do 1945 roku gryzoń ten zasiedlił większość obszaru naszego kraju. Wydaje się, że piżmak zasiedlił cały kraj do końca lat 50. XX w. (Nowak 1966). Występował z pewnością bardzo licznie, gdyż w latach 1949-1963 skupiono w Polsce ponad 700 000 skór tych zwierząt (Nowak 1966). Jedyne do tej pory szczegółowe badania stanu fauny krajowej, których wynikiem było opublikowanie "Atlasu rozmieszczenia ssaków w Polsce" potwierdziły, że gatunek ten występował w całym kraju (Raczyński 1983), z wyjątkiem najwyższych partii Karpat (Jamrozy 1994). Jednak w latach 80. XX wieku nastąpił ogromny spadek liczebności piżmaka w Polsce, tak, że w wielu lokalizacjach wyginął zupełnie (Pielowski i in. 1993). Wydaje się, że jest to cecha naturalna populacji tego gryzonia, które charakteryzują się cyklicznymi (zwykle w cyklu 10-letnim) głębokimi zmianami liczebności (Elton i Nicholson 1942; Erb i in. 2000). Przyczyny tych fluktuacji nie są do końca wyjaśnione, sugeruje się wpływ drapieżnictwa, głównie norki amerykańskiej (Viljugrein i in. 2001), czynniki pokarmowe, pasożyty i choroby.
Zasiedlanie obszaru Polski przez piżmaka trwało około 30 lat i przebiegało więc w formie dość nieregularnej, gdyż oprócz powiększającego się zwartego areału tego gatunku powstawały ciągle oddalone, izolowane od niego stanowiska. Trudno też nawet mówić o stałym kierunku inwazji, gdyż naprzeciw osobnikom rozprzestrzeniającym się ku północy wychodziły często osobniki pochodzące z izolowanych stanowisk znajdujących się na północ od zwartego areału (Nowak 1966). Drogami inwazji piżmaka w Polsce były duże rzeki (głównie Wisła, Warta i Odra), a następnie rozprzestrzenił się on wzdłuż sieci mniejszych cieków i zbiorników wodnych (Nowak 1971). | | | | | | Występowanie na terenach chronionych | | Piżmak zasiedla większość parków narodowych i parków krajobrazowych, gdziekolwiek siedlisko obfituje w zbiorniki i cieki wodne. Spośród polskich parków narodowych nie występuje jedynie na południu naszego kraju, w parkach o charakterze typowo górskim: Tatrzańskim, Babiogórskim, Gorczańskim, Bieszczadzkim, Świętokrzyskim, Karkonoskim i Gór Stołowych (H. Okarma - dane niepubl.). | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Rola piżmaka w ekosystemie jako obcego gatunku inwazyjnego jest słabo poznana, ale zwykle uznaje się ją za mało istotną, tymczasem piżmaki zjadają dziennie pokarm roślinny o masie przewyższającej znacznie masę ich ciała. Fakt ten oraz wykorzystywanie dużej objętości materiału roślinnego do budowania chatek i platform pokarmowych sprawia, że gryzonie te wpływają więc w mocny sposób na wegetację: przede wszystkim na różnorodność gatunkową roślin i ich biomasę (Smirnov i Tretyakov 1998, Connors i in. 2000). Duże zagęszczenie piżmaków sprawia, że roślinność jest wyjedzona i tworzą się znaczne przestrzenie otwartej wody, co zwiększa różnorodność siedliska dla innych zwierząt (Pelikán i in. 1970, Danell 1978). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Negatywna rola piżmaków związana jest głównie z kopaniem przez nie nor w brzegach rzek i naturalnych zbiorników wodnych oraz grobli, wałów i tam utrzymujących reżim wodny wymagany przez człowieka. Nory osłabiają ich odporność na działanie wody, a zapadanie się nor jeszcze bardziej eroduje brzegi. Zdarzają się też przypadki zawalenia się nor pod ludźmi lub sprzętem technicznym poruszającymi się wzdłuż brzegów. Piżmaki budują też swoje domki w rurach melioracyjnych, przez co zupełnie je zatykają i tamują odpływ wody. W Niemczech straty powodowane przez piżmaki w brzegach rzek i różnego rodzaju urządzeniach wodnych szacuje się na ponad 2 mln euro rocznie (Reinhardt i in. 2003). Zdecydowanie mniejszym problemem są szkody w uprawach rolnych, warzywniczych i ogrodach, które zdarzają się lokalnie i przy wysokich zagęszczeniach piżmaków. Największe straty mogą powstawać w uprawach kukurydzy, rzadziej buraków cukrowych, zbóż, koniczyny, marchwi, soi i plantacjach żurawiny (Doude van Troostwijk 1976, Baker 1983, Miller 1994).
Wskazuje się także, że piżmaki są żywicielem pośrednim tasiemca wieńcogłowego Echinococcus multiloculari powodującego groźną chorobę pasożytniczą - bąblowicę. Badania w Niemczech wykazały, że do 28% osobników w populacjach tego gryzonia jest zarażonych tym tasiemcem i sugeruje się, że piżmaki przyczyniają się do rozprzestrzenienia się tego pasożyta (Romig 1999).
Straty w uprawach rolnych można wyeliminować w bardzo prosty sposób przez ogrodzenie upraw od strony wody lub lokowanie ich dalej niż 200 m od wody. Destrukcyjnego wpływu piżmaków na brzegi nie można zupełnie wyeliminować, natomiast można go znacznie ograniczyć przez odpowiednie działania profilaktyczne, np.: formowanie łagodnych spadków linii brzegowej (stosunek 3:1 lub mniejszy) czyni je zdecydowanie mniej atrakcyjnymi dla piżmaków niż strome brzegi; utworzenie półki ziemnej (3 m szerokości) od podstawy tamy w kierunku cieku lub zbiornika wodnego, której górny poziom znajduje się na równi z powierzchnią wody; zabezpieczanie warstwą kamieni lub stalową siatką strefy najbardziej narażonej na działalność piżmaków (od 90 poniżej do 30 cm ponad poziom wody) (Miller 1994).
Piżmak powinien być zwalczany, chociaż jego całkowite wytępienie w Polsce nie jest możliwe, ponieważ bytuje on we wszystkich krajach ościennych. Najbardziej efektywnym sposobem zwalczania gatunku (lub odłowu na futra) są różnego rodzaju pułapki łapiące za nogi lub tułów oraz pułapki klatkowe. W latach 1963-1975 piżmak był nawet skreślony z listy zwierząt łownych, co spowodowało jego masowe wybijanie wszelkimi metodami (Pielowski i in. 1993). Obecnie piżmak jest w Polsce gatunkiem łownym, dlatego jedynym legalnym sposobem jego zwalczania jest odstrzał. Według obowiązującego Rozporządzenia Ministra Środowiska z dnia 16 marca 2005 r. (Dz. U. 2005, nr 48, poz. 459) polowanie na ten gatunek dozwolone jest od 11 sierpnia do 15 kwietnia, a na terenie rybackich obrębów hodowlanych - przez cały rok. | | | | | | Prognoza | | Piżmak wydaje się być gatunkiem bardzo dobrze zadomowionym w Europie Centralnej, a w Polsce zasiedla właściwie wszystkie odpowiadające mu siedliska. Fakt opuszczania przez te gryzonie licznych siedlisk w Polsce pod koniec XX wieku jest wynikiem znacznego zmniejszenia liczebności tych zwierząt, najprawdopodobniej na skutek naturalnych długookresowych fluktuacji ich populacji. W rachubę wchodzi też wzrastające oddziaływanie na piżmaki średnio dużych drapieżników, np. norki amerykańskiej i wydry (Bartoszewicz i Zalewski 2003, Wilson 1954). Jeśli hipoteza o fluktuacjach piżmaka jest trafna, to należałoby oczekiwać, że liczebność tego gatunku znów wzrośnie i ponownie pojawi się on w większości lokalizacji, gdzie był obserwowany pod koniec lat 70. XX wieku. | | | | | | Literatura | | - Amirkhanov A.M. (ed.). 1997. The First National Report of Russian Federation "Biodiversity conservation in Russia". The State Committee of Russian Federation for Environment Protection, Moscow: 1-211.
- Baker R.H. 1983. Michigan mammals. Michigan State University Press: 1-642.
- Bartoszewicz M., Zalewski A. 2003. American mink, Mustela vison diet and predation on waterfowl in the Słońsk Reserve, western Poland. Folia Zoologica 52 (3): 225-238
- Boutin S. 1987. Muskrat. In: Novak M., Baker J.A., Obbard M.E., Malloch B. (eds) Wild furbearer management and conservation in North America. Ontario Ministry of Natural Resources, Toronto: 314-324.
- Böhmer H.J., Heger T., Trepl L. 2001. Fallstudien zu gebietsfremden Arten in Deutschland. Umweltbundesamt, Berlin: 1-126.
- Brooks R.P. 1985. Microenvironments and activity patterns of burrow-dwelling muskrats (Ondatra zibethicus) in rivers. Acta Zoologica Fennica 173: 47-49.
- Chashchukhin V.A. 1987. On muskrat artificial introduction success. Abstracts of 18th IUGB Congress, Kraków, Poland: 38.
- Connors L.M., Kiviat E., Groffman P.M., Ostfeld R.S. 2000. Muskrat (Ondatra zibethicus) disturbance to vegetation and potential net nitrogen mineralization and nitrification rates in a freshwater tidal marsh. American Midland Naturalist 143: 53-63.
- Danell K. 1978. Ecology of the muskrat in northern Sweden. Report of the National Swedish Environmental Protection Board: 1-157.
- Doude van Troostwijk W.J. 1976. The muskrat (Ondatra zibethicus L.) in the Netherlands, its ecological aspects and their consequences for man. Verh, Rijksinst Natuurbeheheer 7: 1-136.
- Elton C., Nicholson M. 1942. Fluctuations in numbers of the muskrat (Ondatra zibethica) in Canada. Journal of Animal Ecology 11: 96-126.
- Erb J., Stenseth N.Ch., Boyce M.S. 2000. Geographic variation in population cycles of Canadian muskrats (Ondatra zibethicus). Canadian Journal of Zoology 78: 1009-1016.
- Errington P.L. 1963. Muskrat populations. Iowa State University Press, Ames: 1-665.
- Gosling L.M., Baker S.J. 1989. The eradication of muskrat and coypus from Britain. Biol. J. Linnean Soc. 38: 39-51.
- Jamrozy G. 1994. Występowanie, rozmieszczenie i stan populacji ssaków łownych w polskich Karpatach. Zeszyty Naukowe Akademii Rolniczej im. Hugona Kołłątaja w Krakowie 190: 1-104.
- MacArthur R.A. 1978. Winter movements and home range of the muskrat. Canadian
- Field-Naturalist 92: 345-349.
- Miller J.E. 1994. Muskrats. In: Hygnstrom S.E., Timm R.M., Larson G.E. (eds) Prevention and control of wildlife damage. University of Nebraska, Lincoln, B: 61-69.
- Nowak E. 1966. Rozprzestrzenienie się, liczebność i znaczenie piżmaka Ondatra zibethica (L., 1766), w Polsce. Przegląd Zoologiczny 10: 221-237.
- Nowak E. 1971. O rozprzestrzenianiu się zwierząt i jego przyczynach. Instytut Ekologii PAN, Zeszyty Naukowe 3: 1-255.
- Neal T. 1968. A comparison of two muskrat populations. Iowa State Journal of Science 43: 193-210.
- Pelikán J., Svoboda J., Kvet J. 1970. On some relations between the production of Typha latifolia and a muskrat population. Zool. Listy 19: 303-320.
- Pielowski Z., Kamieniarz R., Panek M. 1993. Raport o zwierzętach łownych w Polsce. Biblioteka Monitoringu Środowiska, Warszawa: 62-63.
- Proulx G., Gilbert F.F. 1983. The ecology of muskrat, Ondatra zibethicus, at Luther Marsh, Ontario. Canadian Field-Naturalist 97: 377-390.
- Raczyński J. 1983. Ondatra zibethicus (Linnaeus, 1766). W: Pucek Z., Raczyński J. (red.). Atlas rozmieszczenia ssaków w Polsce. PWN, Warszawa: 100-103 + mapa nr 0087.
- Reinhardt F., Herle M., Bastiansen F., Streit B. 2003. Economic Impact of the Spread of Alien Species in Germany. R+D Project 201 86 211 (UFOPLAN). Des Bundesministeriums für Umwelt, Naturschutz und Reaktorsicherheit: 1-194.
- Romig T. 1999. Vorkommen und Diagnostik von Echinococcus multilocularis bei Wildund Haustieren. Deutsche Tierärztliche Wochenschrift 106: 352-357.
- Ruprecht A.L. 1974. Craniometric variations in Central European populations of Ondatra zibethica Linnaeus, 1766. Acta Theriologica 19: 463-507.
- Stewart R.W., Bider J.R. 1974. Reproduction and survival of ditch-dwelling muskrats in southern Québec. Canadian Field- Naturalist 88: 420-436.
- Smirnov V.V., Tretyakov K. 1998. Changes in aquatic plant communities on the island of Valaam due to invasion by the muskrat Ondatra zibethicus L. (Rodentia, Mammalia). Biodiversity and Conservation 7: 673-690.
- Viljugrein H., Lingjarde O.Ch., Stenseth N.Ch., Boyce M. S. 2001. Spatio-temporal patterns of mink and muskrat in Canada during a quarter century. Journal of Animal Ecology 70: 671-682.
- Vincent J.P., Quéré J.P. 1972. Quelques données sur la reproduction et sur la dynamique des populations du rat musqué Ondatra zibethicaL. dans le nord de la France. Ann. Zool. Ecol. Anim. 4: 395-415.
- Willner G.R., Feldhamer G.A., Zucker E.E., Chapman J.A. 1980. Ondatra zibethicus. Mammalian Species 141: 1-8.
- Willson K.A. 1954. The role of mink and otter as muskrat predators in northeastern North Carolina. The Journal of Wildlife Management 18 (2): 199-207
- Zima J. 1999. Ondatra zibethicus (Linnaeus, 1766). In: Mitchell-Jones A.J., Amori G., Bogdanowicz W., Kryštufek B., Reijnders P.J.H., Spitzenberger F., Stubbe M., Thissen J.B.M., Vohralík V., Zima J. (eds) The atlas of European mammals. T & A.D. Poyser Natural History, London: 224-225.
| | | | | | Streszczenie | | Original range of the species distribution covered nearly all North America. In 1905 few individuals were introduced to Europe (western Czech) and the rapidly growing population expanded in all directions at a spectacular rate. Additionally, at the beginning of the 20th century muskrats were kept in a few fur farms and escaped individuals started several new populations. Intentional introductions on a large scale (hundred thousands animals) were also conducted in the former Soviet Union and Finland. Currently, muskrats occur in western, central and north-eastern Europe. In the British Isles they were eradicated in the 1930s.
Within the current borders of Poland the first muskrats were observed in the southwestern part of the country in 1924. These individuals originated probably from the expanding Czech population and later colonized areas along the Odra River. There were also established several muskrat fur farms in Poland in the late 1920s and early 1930s. Most of the fur farms were liquidated after 1934, however, it was already impossible to stop the process of Muskrat expansion. In the late 1950s muskrats were recordes in the most part of Poland, except in the Carpathian Mountains. In the 1980s, a dramatic decrease in population numbers of these animals occurred in Poland and as a result the species disappeared completely from many locations. Currently, Muskrat inhabits most of the country but its distribution is scattered and numbers are low.
The impact of Muskrat of native ecosystems and species is little known. Often it is considered to be neglible, however, the facts that one individual consumes every day high amounts of plant matter (greater than its body mass) and that it uses considerable volumes of plant material to construct lodges and feeding platforms suggest that muskrats may have a heavy impact on vegatation. An important negative aspect of Muskrat presence is its burrowing activity. These animals dig numerous and long burrows in river banks, dams and dikes which weaken their structure, often leading to breaking them by water. For example, in Germany the annual costs of muskrat damage (and eradiacation of individuals in such locations) have been estimated as more that 2 millions euro. Damage to agriculture crops (maize, corns, beet root) is local and small-scale.
Muskrat numbers should be controlled, however, efforts at its eradication in Poland will never succeed because its continuous distribution range covers all our neighboring countries. Additionally, Muskrat is a game species in Poland, which means that the only way of harvest is hunting. The use of the most effective eradication measures, i.e. various traps, is forbidden. | | | | | | Opracowanie | | Henryk Okarma | | | | |
|