
Pseudorasbora parva (Schlegel, 1842)
czebaczek amurski
Stone Moroco, Topmouth Gudgeon |   | Rodzina | | Cyprinidae karpiowate | | Rząd | | Cypriniformes karpiokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
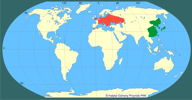
 | | | | | | Uwagi taksonomiczne | | Rodzaj Pseudorasbora obejmuje cztery gatunki występujące we wschodniej Azji, z których P. parva została introdukowana na obszar Europy (Bănărescu i Nalbant 1977, Bănărescu 1999). P. parva jest gatunkiem politypowym. Nichols (1943) z terytorium Chin wymienia 6 podgatunków. Według Bănărescu, Nalbant (1965) i Bianco (1988) pozycja systematyczna większości z nich nie jest w pełni jasna. Uważa się, że europejskie populacje reprezentowane są przez nominatywny podgatunek (P. parva parva), choć Baruš i in. (1984) zaliczają je do podgatunku P. parva fowleri. | | | | | | Locus typicus/Terra typica | | Region Nagasaki, Japonia. | | | | | | Pierwotna ojczyzna gatunku | | Subregion wschodnioazjatycki ("mandżurski"), obejmujący dorzecze Amuru, Jangcy, Huang-ho, wyspy japońskie (Kiusiu, Sikoku oraz południową i centralną część Honsiu), zachodnią i południową część półwyspu koreańskiego oraz Tajwan - system rzeki Minkjang (Berg 1949, Bănărescu 1999). | | | | | | Podstawowe cechy morfologiczne | | Czebaczek amurski ma ciało wydłużone, z boków lekko ścieśnione, pokrojem przypominające kiełbie z rodzaju Gobio. Głowa niewielka, lekko spłaszczona w przedniej części. Pysk wyraźnie górny. Płetwy grzbietowa i odbytowa krótkie, płetwa ogonowa duża i głęboko wcięta, a oba płaty mają zbliżone rozmiary. Płetwy brzuszne osadzone są nieco do przodu w stosunku do płetwy grzbietowej. Gardło pokryte łuskami. Linia naboczna pełna, biegnie środkiem boków. Łuski są cykloidalne i duże. Ubarwienie obu płci jest podobne: grzbiet jest szary, boki i brzuch są jasne, przechodzące od koloru żółtawozielonego do srebrzystego. U młodych osobników od głowy wzdłuż boków ciała biegnie ciemny pas, który z wiekiem zanika. W kaudalnej części łusek pigment tworzy charakterystyczne półksiężycowate plamy. Płetwy są blade, jasnożółte, a tylko na grzbietowej znajduje się ciemniejszy prążek, biegnący skośnie do tyłu (Witkowski 1991a,b; Kotusz i Witkowski 1998).
Dymorfizm płciowy zaznacza się wyraźnie w okresie tarła. U samców pojawia się na głowie wysypka tarłowa. Największe zgrupowanie ostrych brodawek (ok. 14) występuje w przedniej części głowy (na czole) w pobliżu otworów nosowych oraz nad i pod okiem. Niewielką ilość brodawek (ok. 4) obserwuje się także na wardze dolnej. W tym okresie samce wyraźnie ciemnieją, a ich płetwy stają się czarne, zaś wieczko skrzelowe przyjmuje odcień fioletowy. Samice w tym okresie są wyraźnie jaśniejsze od samców (Berg 1949, Muchačeva 1950, Anhelt i Tiefenbach 1991). | | | | | | Biologia, ekologia | | Czebaczek amurski zarówno na obszarze swojego naturalnego występowania, jak i na terenach, na które został introdukowany, zasiedla głównie płytkie jeziora, starorzecza, stawy karpiowe, kanały irygacyjne, rowy oraz wolno płynące odcinki nizinnych rzek. Preferuje partie akwenów mocno porośnięte roślinnością zanurzoną i wynurzoną (Berg 1949, Muchačeva 1950, Kozlov 1974, Witkowski 2000), choć toleruje również cieki silnie zmienione przez człowieka (Kruk i in. 2003).
Do tarła przystępuje po skończeniu pierwszego roku życia. W dorzeczu Amuru rozpoczyna tarło, gdy woda osiągnie temperaturę 15-19°C (maj-sierpień), natomiast w Europie trze się wcześniej - w kwietniu-czerwcu (Baruš i in. 1984, Giurca i Angelescu 1971). Płodność P. parva waha się od kilkuset do kilku tysięcy ziaren ikry w sezonie. Jaja są elipsoidalne (w podłużnej osi 2,0-2,5 mm), lepkie, o żółtawym zabarwieniu. Ikra składana jest na roślinach, piasku, kamieniach, muszlach mięczaków i innych rodzajach substratu (indyferentna grupa rozrodcza) (Muchačeva 1950, Kozlov 1974, Mopan i Smirnov 1981, Baruš i in. 1984). Tarło jest wielomiotowe i ma miejsce w strefie przybrzeżnej. Przed tarłem samiec dokładnie oczyszcza podłoże, na którym złożona będzie ikra. W czasie jednego aktu samica składa do kilkudziesięciu ziaren ikry. Jeden samiec może odbywać tarło z kilkoma kolejnymi samicami. Do momentu wylęgnięcia się larw samiec strzeże ikry i agresywnie odgania często większe od niego ryby (Šebela i Wohlgemuth 1984). Rozwój zarodkowy tego gatunku w wodzie o temperaturze 20-28°C trwa 4-8, a larwalny 41-42 dni (Kozlov 1974, Makajeva i Zaki Mochamed 1982, Šebela i Wohlgemuth 1984, Półtorak 1995).
Młodociane stadia (wylęg, narybek) odżywiają się fito- i zooplanktonem (Chyoboridae, Bominidae, Copepoda, Rotatoria). Starsze osobniki są bentofagami, a najczęściej zjadają larwy widelnic Plecoptera, chruścików Trichoptera, muchówek ochotkowatych Chironomidae, oraz niektóre skorupiaki Crustacea. Czebaczek w niewielkim stopniu wykorzystuje też pokarm roślinny. W warunkach stawowych pokarm tego gatunku w dużym stopniu pokrywa się z pokarmem gatunków hodowlanych (głównie karpia), dlatego też przy masowym występowaniu może on poważnie uszczuplać ich zasoby pokarmowe (Muchačeva 1950, Nikolski 1956, Kozlov 1974, Mopan i Kozlov 1978, Xie i in. 2001). W warunkach naturalnych gatunek ten osiąga długość do 11 cm, ciężar ciała do ok. 19 g i dożywa wieku 3-4 lat (Berg 1949, Muchačeva 1950). Hodowany w akwariach żyje 5 i więcej lat, może też osiągać rozmiary nawet do 15 cm (Šebela i Wohlgemuth 1984, Witkowski 2000). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Na kontynent europejski gatunek został zawleczony w materiale zarybieniowym gatunków roślinożernych, jak amur biały Ctenopharyngodon idella, tołpyga biała Aristichthys noblis, tołpyga pstra Hypophathalmichthys molitrix. Po raz pierwszy został stwierdzony w 1961 r. w południowej Rumunii (w gospodarstwie rybackim Nucet - dorzecze Dimbovity) i w Albanii (Bănărescu i Nalbant 1965, Knezevič i in. 1978).
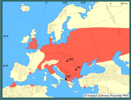
W ciągu 40 lat rozprzestrzenił się na obszar prawie całej Europy, północnej Afryki (Algieria, Maroko), Bliskiego Wschodu (Turcja, Iran), środkowej Azji (Kazachstan, Uzbekistan), a nawet Oceanii (Fidżi) - głównie przypadkowo wraz z materiałem zarybieniowym innych gatunków ryb. Tylko w kilku przypadkach został wprowadzony celowo jako ryba paszowa lub akwaryjna (Wohlgemuth i Šebela 1987, Welcomme 1988, Arnold 1985, Coad i Abdoli 1993, Witkowski 1991a, Perdices i Doadrio 1992, Wildekamp i in. 1997, Bănărescu 1999, Gozlan i in. 2002).
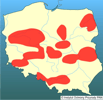
W Europie pod koniec lat 60 gatunek ten spotykany był już w wielu regionach i systemach rzecznych Rumunii, łącznie z deltą Dunaju. Rozprzestrzeniający się tą rzeką czebaczek został odnotowany w 1963 r. na Węgrzech. Nie jest wykluczone, że dotarł tam również z wylęgiem amura i tołpyg importowanych do kilku gospodarstw karpiowych. W następnych latach był już spotykany w większości stawów hodowlanych oraz w wodach otwartych, łącznie z jeziorem Balaton (Biró 1972). W 1972 r. czebaczek amurski został odnotowany w europejskiej części ówczesnego ZSRR - delcie Dunaju i w Dniestrze (Kozlov 1974). Bănărescu (1999) uważa, że na niektóre obszary dawnego ZSRR (Wołga, Don, Dniestr, Niemen) mógł być introdukowany znacznie wcześniej, jeszcze przed rokiem 1961. Na teren ówczesnej Czechosłowacji gatunek ten prawdopodobnie przedostał się z Węgier. Po raz pierwszy odnotowany został we wschodniej Słowacji w 1974 r. w dorzeczu Cisy (Žitnan i Holčik 1976). W następnych latach (1982) stwierdzono obecność czebaczka na ponad 20 stanowiskach, w tym na kilku w pobliżu granicy z Polską (okr. Karvina) (Wohlgemuth 1986, Wohlgemuth i Šebela 1987). Lohniský i Oulehla (1993) uważają, że gatunek ten na terenie Czech (Morawy) występował wcześniej, bowiem już w latach 1965-1971 w stawach Pohořelickich występował licznie. W 1972 r. P. parva odkryto po raz pierwszy w Jugosławii (Jezioro Szkoderskie), później (1979 r.) w jez. Sasko (Knezevič 1981, Knezevič i in. 1978). Gatunek ten przeniknął tam z Albanii, gdzie był wcześniej świadomie wprowadzony (1961?) jako pokarm dla ryb drapieżnych. Pod koniec lat 70. został stwierdzony we Francji w regionie Sarthe, a później w Rodanie. Zarówno francuskie, jak i (później, w 1988 r.) włoskie populacje prawdopodobnie dostały się poprzez system wodny Dunaj-Men-Ren (Allardi i Chanceler 1988; Allardi i Keith 1991, Sala i Spampanato 1991, Keith i Allardi 1998, Caiola i Sostoa 2002). W 1982 r. i następnych latach gatunek ten odnotowano w Austrii w rzece March (Weber 1984), w Niemczech wschodnich, po raz pierwszy w rzece Weisse Elster (Arnold 1985). Późniejsze pojawienia były związane z samoistnym przenikaniem w górę Dunaju (Stein i Herl 1986, Bianco 1988). Wykorzystując kanały łączące Dunaj-Men-Ren i dalej tą rzeką czebaczek amurski rozprzestrzenił się na obszar zachodniej Europy, gdzie aktualnie odnotowywany jest w Belgii i Holandii (Gozlan i in. 2002). W latach 70. i 80. stwierdzono jego obecność również w Bułgarii (1975 r.), północnej Grecji (rz. Aliakmon, Macedonia - 1987 r.), Turcji (Tracja - 1982, Anatolia - 1996r.) (Marinov 1979, Erk'akan 1984, Bianco 1988, Bojadijev i Bassamakov 1988, Jankowic i Karapetkova 1992, Rosecchi i in. 1993, Şaşi i Balik 2003). Gatunek ten odkryto ostatnio również w Hiszpanii w rzece Ebro (2001 r.), północnych i środkowych Włoszech (Perdices i Doadrio 1992) oraz południowej i środkowej Anglii, Walii oraz Danii (Domaniewski i Wheeler 1996, Caiola i Sostoa 2002, Gozlan i in. 2002, Olesen i in. 2003, Pinder i in. 2005). W połowie lat 90. odnotowano obecność P. parva na kilku izolowanych stanowiskach w północnej Afryce (Perdices i Doadrio 1997). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | W Polsce odnotowany po raz pierwszy w 1990 r. w Państwowym Gospodarstwie Rybackim Stawno w dolinie Baryczy k. Milicza. Prawdopodobnie został tam przypadkowo zawleczony już w drugiej połowie lat 80. (1987?) z materiałem zarybieniowym karpia i ryb roślinożernych sprowadzanym z Węgier lub Czech, na co wskazywała kilkupokoleniowa (2-3 roczniki) struktura odłowionej populacji (Witkowski 1991a,b). W roku następnym gatunek ten odnotowany został w sąsiednim gospodarstwie rybackim - Rudzie Sułowskiej, jak również w Baryczy i jej dopływach (Błachuta i in. 1993). Prawdopodobnie z gospodarstw rybackich Doliny Baryczy czebaczek amurski rozpoczął szybką ekspansję, głównie z materiałem zarybieniowym innych gatunków ryb, na prawie cały obszar Polski. Do końca lat 90. odnotowany był w innych regionach Dolnego Śląska (okolice Jeleniej Góry i Legnicy), w Wielkopolsce (okolice Środy Wlkp., Sierakowa, Miłosławia, Międzyrzecza, Lutomia, Osieczna, Zgnilic), Małopolsce (okolice Brzeska, Pławowic), Mazowszu (Żabieniec) (Kotusz i Witkowski 1998, Witkowski 2002). W ostatnim okresie gatunek ten został stwierdzony w Puszczy Kozienickiej (Zagożdżonka), Wyżynie Łódzkiej (Ner), na Mazowszu (dopływy Wkry), Podlasiu (okolice Supraśla, Biebrza), w dopływach Prosny, a także w dopływach górnej Odry - Osobłodze, Straduni, Olzie, Psinie i Rudej (Lojkasek i in. 2000, Witkowski i in. 2000, Kruk i in. 2003, Penczak i in. 2004, Kusznierz i in. 2005, Marszał i in. 2005, Witkowski i Wiśniewolski 2005).
Obecnie gatunek ten w Polsce jest już szeroko rozprzestrzeniony, głównie w środkowych i nizinnych regionach, gdzie zasiedla stawy hodowalne, drobne zbiorniki, jeziora oraz rzeki - w tym również małe cieki i rowy melioracyjne.
Na dotychczas odnotowanych obszarach występowania, szczególnie w stawach karpiowych, gatunek ten występuje już licznie. O możliwości masowego występowania w wielu regionach Polski może świadczyć fakt, że podczas spuszczania jednego stawu w gospodarstwie rybackim Ruda Sułowska (1993 r.) odłowiono i wypuszczono do systemu Baryczy ok. 300 kg czebaczka amurskiego. Podobnie przedstawia się sytuacja tego gatunku w niektórych stawach południowych Czech, gdzie jego zagęszczenie wahało się od 370 do 14 331 osobników/ha, a biomasa od 2,28 do 8,12 kg/ha (Adamek, Sukop 2000). Czebaczek może zdominować też zespoły ryb w rzekach. Sytuacja taka miała miejsce w rzece Sumina (dopływ Rudy na Górnym Śląsku), gdzie jego liczebność w 2005 r. wynosiła kilka tysięcy osobników na 100 m2 cieku, wielokrotnie przekraczając liczebność pozostałych gatunków ryb (J. Kotusz - inf. ustna). | | | | | | Występowanie na terenach chronionych | | Z dotychczasowych informacji wynika, że gatunek ten występuje już licznie na kilku obszarach chronionych, zlokalizowanych głównie w nizinnej części Polski, m.in. w: Biebrzańskim Parku Narodowym, Wielkopolskim PN, PN "Ujście Warty", Kozienickim Parku Krajobrazowym, PK "Dolina Baryczy", PK "Dolina Bobru" (Kotusz i Witkowski 1998, Witkowski i Wiśniewolski 2005). | | | | | | Wpływ na ekosystemy i gatunki rodzime | | W stawach karpiowych, zwłaszcza podczas masowego występowania, konkuruje o pokarm z hodowlanymi gatunkami ryb (Kozlov 1974, Movčan i Smirnov 1981). Zjada tam większe gatunki skorupiaków planktonowych, co powoduje zwiększenie ilości fitoplanktonu, a w efekcie prowadzi to do wzrostu eutrofizacji tych akwenów (Adamek i Sukop 2000). W wodach otwartych i hodowlach stawowych południowej Europy czebaczek amurski prawdopodobnie przyczynił się do zmniejszenia liczebności, a nawet zaniku niektórych autochtonicznych gatunków ryb z rodziny karpiowatych (wzdręga Scardinius erythrophthalmus, karaś Carassius carassius, różanka Rhodeus sericeus, kiełb Gobio gobio, słonecznica Leucaspnis delineatus) poprzez wyjadanie ich ikry i młodocianych stadiów ryb (Giurca i Angelescu 1971, Žitnan i Holčik 1976, Bănărescu 1999). W większym zagęszczeniu może stwarzać wielkie zagrożenie dla rzadkich i ginących gatunków ryb (Winfield i Durie 2004). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Gatunek ten z racji bardzo szybkiego rozprzestrzeniania się, negatywnego oddziaływania na rodzime hydrobionty i przenoszenia infekcyjnych chorób (blisko związanych z Sphaerothecum destruens (Protista: Mezomycetozoea)) uważany jest w Europie za "international pest species" (Welcomme 1992, Gozlan i in. 2005, Pinder i in. 2005).
Ze względu na bardzo liczne już występowanie oraz biologię gatunku, wyeliminowanie lub ograniczenie liczebności czebaczka w wodach otwartych jest już praktycznie niemożliwe. Nie-mniej jednak przy sprowadzaniu materiału zarybieniowego do gospodarstw rybackich i zarybianiu wód otwartych należy zwracać szczególną uwagę na "czystość" obsady gatunkowej. Niezależnie od tego należy zaprzestać używania czebaczka jako "żywca" przy połowie ryb drapieżnych. W stawowych gospodarstwach karpiowych zaleca się przed obsadzeniem karpiem wpuścić na krótki okres, a potem odłowić, rodzime ryby drapieżne - sandacza Stizostedion luciperca i szczupaka Esox lucius (Giurca i Angelescu 1971). Adamek i Sukop (2000) uważają jednak, że czebaczek amurski ze względu na zbyt małe rozmiary nie stanowi obiektu zainteresowania rodzimych drapieżników, a jedynie okoń Perca fluviatilis może być dla niego potencjalnym zagrożeniem.
Gatunek nie jest objęty żadną z form ochrony. Jednym z możliwych działań (zresztą mało skutecznych) jest zastosowanie się do rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dn. 12 listopada 2001 r. (Dz. U. 2001, Nr 138, poz. 1559, § 8 z późn. zm.) oraz Regulaminu Amatorskiego Połowu Ryb PZW, które zakazują wpuszczania obcych gatunków ryb (w tym czebaczka) do łowiska, w którym je złowiono oraz do innych wód. | | | | | | Prognoza | | Ekspansji tego gatunku sprzyja przede wszystkim działalność człowieka, polegająca na zarybianiu wód otwartych oraz akwenów poddawanych intensywnej gospodarce rybackiej. Szczególnie stosowanie najmłodszych asortymentów zarybieniowych karpia i innych ryb stawowych stwarza niebezpieczeństwo wprowadzenia domieszki wylęgu i narybku czebaczka amurskiego. Rozprzestrzenianiu sprzyja połączenie kanałami większości systemów rzecznych Europy. Problem ten dotyczy zarówno akwenów naturalnych, jak również cieków zanieczyszczonych i uregulowanych, w których czebaczek może zajmować siedliska zwolnione przez rodzime gatunki reofilne, pogłębiając kryzys różnorodności biologicznej polskich wód (Kruk i in. 2003). W zasiedlaniu nowych akwenów/obszarów z systemami wodnymi pomagają również wędkarze, bowiem często stosowany jest on jako "żywiec" przy połowie ryb drapieżnych. Szybką ekspansję gatunek ten zawdzięcza również niewielkim rozmiarom ciała i biologii - trybowi życia (ukrywa się w gęsto zarośniętych partiach akwenów), szerokiemu spektrum pokarmowemu i tolerancji środowiskowej, zdolności rozrodu na różnych substratach, wielomiotowości oraz sprawowanej opiece nad złożoną ikrą (Witkowski 2000). Z dotychczasowych faktów odnotowanych na terenie Polski i innych obszarach, na które gatunek ten został zawleczony, wynika, że podjęte dotąd metody zapobiegania i zwalczania przypadkowym introdukcjom okazały się całkowicie nieskuteczne (Witkowski 2005). Należy spodziewać się, że w krótkim czasie (10-15 lat) zarówno w Polsce, jak i innych europejskich krajach gatunek ten w akwenach i rzekach nizinnych może stać się liczebnościowym dominantem. | | | | | | Literatura | | - Adamek Z., Sukop I. 2000. Vliv střevličky východni (Pseudorasbora parva) na parametry rybničniho prostředi. Biodiverzita Ichtiofauny ČR 3: 37-43.
- Allardi J., Chanceler F. 1988. Note ichtyologique sur la présence en France de Pseudorasbora parva (Schlegel, 1842). Bulletin Français de la Peche et de la Pisciculture 308: 35-37.
- Allardi J., Keith P. (eds) 1991. Atlas préliminare des poissons d'eau douce de France. Museum National d'Histoire Naturelle, Paris: 1-234.
- Anhelt H., Tiefenbach O. 1991. Zum auftreten des Blaubandbärblings (Pseudorasbora parva) (Teleostei: Gobioninae) in den Flüssen Raab und Lafnitz. Österreichs Fischerei 44: 19-26.
- Arnold A. 1985. Pseudorasbora parva (Schlegel, 1842) nun auch in der DDR! Zeitschrift Binnenfischerei DDR 32: 182-183.
- Bănărescu P. 1999. Pseudorasbora parva (Temmnick et Schlegel 1846). In: P. Bănărescu (ed.) The freshwater fishes of Europe. 5.I. Cyprinidae 2/I. AULA Verlag, Wiesbaden: 207-224.
- Bănărescu P., Nalbant T. 1965. Studies on the systematics of Gobioninae (Pisces: Cyprinidae). Revue Roumaine de Biologie, Ser. Zoologie 10: 219-229.
- Bănărescu P., Nalbant T. 1977. Pisces, Teleostei, Cyprinidae (Gobioninae). Das Tierreich, Lief. 93, W. De Gruyter, Berlin: 1-304.
- Baruš V., Kux Z., Libosvarsky J. 1984. On Pseudorasbora parva (Pisces) in Czechoslovakia. Folia Zoologica 33: 5-18.
- Berg L.S. 1949. Ryby presnych vod SSSR i sopredelnych stran. Izdatielstvo Akademii Nauk SSSR, Moskva-Leningrad 2: 477-925.
- Bianco P.J. 1988. Occurrence of Asiatic gobionid Pseudorasbora parva (Temmnick and Schlegel) in south-eastern Europe. Journal of Fish Biology 32: 973-974.
- Biró P. 1972. Pseudorasbora parva a Balatondon. Halaszat 18: 11-13.
- Błachuta J., Kuszewski J., Kusznierz J., Witkowski A. 1993. Ichtiofauna dorzecza Baryczy. Roczniki Naukowe Polskiego Związku Wędkarskiego 6: 19-48.
- Bojadijev A., Bassamakov I. 1988. Sur la dissémination de la Pseudorasbora parva (Schlegel, 1842) en Bulgarie. Naucnoje Trudy Plovdivskogo Universiteta Paisii Hilendarski 26: 67-73.
- Caiola M., Sostoa A. 2002. First record of the Asiatic cyprinid Pseudorasbora parva in the Iberian Peninsula. Journal of Fish Biology 61: 1058-1060.
- Coad B.W., Abdoli A. 1993. Exotic fish species in the fresh waters of Iran. Zoology in the Middle East 9: 65-80.
- Domaniewski J., Wheeler A. 1996. The topmouth gudgeon has arrived. Fish: 40- 43.
- Erk'akan F. 1984. Trakya Bölgesinden Tűrkiye icin yeni kayit olan bir balik tűrű, Pseudorasbora parva (Pisces, Cyprinidae). Doga Bilim Dergisi A2: 350-351.
- Giurca R., Angelescu N. 1971. Consideratii privinid biologia sia aria de raspindire geografica a cyprinidului Pseudorasbora parva (Schlegel) in apele Romaniei. Bulletin Cercetari Piscicole 30: 99-109.
- Gozlan R.E., Pinder A.C., Shelley J. 2002. Occurrence of the Asiatic cyprinid Pseudorasbora parva in England. Journal of Fish Biology 61: 298-300.
- Gozlan R.E., St-Hilaire S., Feist S.W., Martin P., Kent M.L. 2005. Disease threat to European fish. Nature 435: 1046.
- Jankovic D., Karapetkova M. 1992. Present status of the studies on range of distribution of Asian fish species Pseudorasbora parva (Schlegel 1842) in Yugoslavia and Bulgaria. Ichthyologia 24: 1-9.
- Keith P., Allardi J. 1998. The introduced freshwater fish of France: status, impacts and management. In: Cowx I. G. (ed.) Stocking and introduction of fish. Fishing News Books/Blackwell Science, Oxford. Chapter 13: 153-166.
- Knezevič B. 1981. Pseudorasbora parva, new genus and species in Lake Skardar. Glasnik Republickogo Zarvoda Zastihi za Prirode Muzeja 14: 79-84.
- Knezevič B., Vukovič T., Kavarič M. 1978. Pseudorasbora parva (Schlegel). Nova vrsta za ihtiofaunu Jugoslavie. Ribie Jugoslavie 33: 140-142.
- Kotusz J., Witkowski A. 1998. Morphometrics of Pseudorasbora parva (Schlegel, 1842) (Cyprinidae: Gobioninae), a species introduced into the Polish waters. Acta Ichthyologica et Piscatoria 28: 3-14.
- Kozlov V.I. 1974. Amurskij čebačok - Pseudorasbora parva (Schl.) - novyj vid ichtiofauny bassejna Dnestra. Vestnik Zoologii 1: 77-78.
- Kruk A., Kotusz J., Szymczak M., Spychalski P. 2003. Czebaczek amurski Pseudorasbora parva (Schlegel, 1842) (Cyprinidae, Gobioninae) - nowy element w ichtiofaunie województwa łódzkiego. Roczniki Naukowe Polskiego Związku Wędkarskiego 16: 97-101.
- Kusznierz J., Kotusz J., Popiołek M., Witkowski A. 2005. The ichthyofauna of the upper Odra basin (Polish part). Roczniki Naukowe Polskiego Związku Wędkarskiego 18: 59-91.
- Lohniský K., Oulehla O. 1993. Vyskýt střevličky východni, Pseudorasbora parva (Schlegel, 1842) ve východnich Čechách a na Znojemsku (Teleostei: Gobioninae). Acta Musei Reginaehradecensis, S. A., Scientiae Naturales 23: 47-64.
- Lojkasek B., Lusk S., Halačka K., Luskova V. 2000. Fish communities in the drainage area of the Osoblaha River and effect of the 1997 flood. Czech Journal of Animal Sciences 45: 229-236.
- Makajeva A.P., Zaki Mochamed M.I. 1982. Razmnoženije i razvitje psevdorasbory Pseudorasbora parva (Schlegel) v vodojemach Srednej Azji. Voprosy Ichtiologii 22: 80-92.
- Marinov B. 1979. Pseudorasbora parva (Schlegel, 1842) (Pisces: Cyprinidae) - a new representative of the ichthyofauna of Bulgaria. Hidrobiologia 8: 75-78.
- Marszał L., Kruk A., Koszaliński H., Tybulczuk S., Zięba G., Grabowska J., Penczak T. 2005. Ichtiofauna systemu rzeki Wkry. Część II. Dopływy. Roczniki Naukowe Polskiego Związku Wędkarskiego 18: 5-28.
- Movčan Y.V., Kozlov V.I. 1978. Morfologičeskaja charakteristika i nekotoryje čerty ekologii amurskogo čebačka (Pseudorasbora parva (Schlegel)) v vodojemach Ukrainy. Gidrobiologičeskij Žurnal 14: 42-48.
- Movčan Y.V., Smirnov A.J. 1981. Fauna Ukrainy. 8 Ryby. Koropovi 1. Akademia Nauk USSR, Kiiv: 1-425.
- Muchačeva V.A. 1950. K biologii amurskogo čebačka Pseudorasbora parva (Schlegel). Trudy Amurskoj Ichtiologičeskoj Ekspedicji, 1945-1949, 1: 365-374.
- Nichols J.T. 1943. The fresh-water fishes of China. 9. Natural History of Central Asia. American Museum of Natural History, New York: 1-322.
- Nikolski G.V. 1956. Ryby bassejna Amura. Izdatielstvo Akademii Nauk SSSR, Moskva: 1-551.
- Olesen T.M., Nielsen J., Moller P.R. 2003. Bandgrundling Pseudorasbora parva (Temminck & Schlegel, 1864) - ny ynglefisk in Danmark. Flora og Fauna 109: 1-5.
- Penczak T., Kruk A., Marszał., Zięba G., Kostrzewa, Koszaliński H., Tybulczuk S. 2004. Ichtiofauna systemu rzeki Prosny. Część II. Dopływy Prosny. Roczniki Naukowe Polskiego Związku Wędkarskiego 17: 55-76.
- Perdices A., Doadrio I. 1992. Presence of the Asiatic cyprinid Pseudorasbora parva (Schlegel 1842) in acque interne Italiane. Rivista di Idrobiologia 29: 461-467.
- Perdices A., Doadrio I. 1997. Presence of the Asiatic cyprinid Pseudorasbora parva Schlegel, 1842) in North Africa. Miscellania Zoologica 16: 236-237.
- Pinder A. C., Gozlan R.E., Britton J.R. 2005. Dispersial of the invasive topmouth gudgeon Pseudorasbora parva in the UK: a vector for an emergent infectious disease. Fishery Management and Ecology 12: 411-414.
- Półtorak B. 1995. Rozwój zarodkowy i larwalny Pseudorasbora parva (Schlegel, 1842) (Cyprinidae, Pisces). Instytut Zoologiczny Uniwersytu Wrocławskiego (maszynopis).
- Rosecchi E., Crivelli A., Catsadorakis G. 1993. The establishment and impact of Pseudorasbora parva, an exotic fish species introduced into Lake Mikri Prespa (north-western Greece). Aquatic Conservation: Marine and Freshwater Ecosystems 3: 223-231.
- Sala L., Spampanato A. 1991. Prima segnalazione de Pseudorasbora parva (Schlegel 1842) in acque interne Italiane. Rivista di Idrobiologia 29: 461-467.
- Stein H., Herl O. 1986. Pseudorasbora parva - eine neue Art der mitteleuropaischen Fischfauna. Zeitschrift für Binnenfischerei 36: 1-2.
- Şaşi H., Balik S. 2003. The distribution of three exotic fishes in Anatolia. Turkish Journal of Zoology 27: 319-322.
- Šebela M., Wohlgemuth E. 1984. Některá pozorováni Pseudorasbora parva (Schlegel, 1842) (Pisces, Cyprinidae) v chovu. Časopis Moravskeho Muzea 69: 187-194.
- Weber E. 1984. Die Ausbreitung der Pseudokeilfleckenbarben in im Donauraum. Österreichs Fischerei 33: 63-65.
- Welcomme R.L. 1988. International introductions of inland aquatic species. FAO Fisheries. Technical Paper 294: 1-318.
- Welcomme R.L. 1992. A history of international introductions of inland aquatic species. ICES Marine Science Symposia 194: 3-14.
- Wildekamp R., Van Neer H., Kücük W., Ülsüsayin F. 1997. First record of eastern Asiatic gobionid fish Pseudorasbora parva from the Asiatic part of Turkey. Journal of Fish Biology 51: 858-861.
- Winfield I.J., Durie N.C. 2004. Fish introductions and their management in the English Lake District. Fishery Management and Ecology 11: 195-201.
- Witkowski A. 1991a. Pseudorasbora parva (Schlegel, 1842) (Cyprinidae, Gobioninae) nowy gatunek w polskiej ichtiofaunie. Przegląd Zoologiczny 35: 323-331.
- Witkowski A. 1991b. Czebaczek amurski (Pseudorasbora parva) - kolejny zawleczony gatunek w naszej ichtiofaunie. Komunikaty Rybackie 4: 23-25.
- Witkowski A. 2000. Czebaczek amurski - Pseudorasbora parva (Schlegel, 1842). W: Brylińska M. (red.) Ryby słodkowodne Polski. Państwowe Wydawnictwo Naukowe, Warszawa: 335-337.
- Witkowski A. 2002. Introduction of fishes into Poland: benefaction or plague. Nature Conservation 59: 41-52
- Witkowski A. 2005. Pseudorasabora parva. NOBANIS - Invasive Alien Species Fact Sheet. www. artportalen.se/nobanis/.
- Witkowski A., Błachuta J., Kotusz J., Kusznierz J. 2000. Lampreys and fishes of the upper and middle Odra basin (Silesia, SW Poland) - The present situation. Acta Hydrobiologica 42: 283-303.
- Witkowski A., Wiśniewolski W. 2005. Ryby i minogi Biebrzy, jej starorzeczy i dopływów. W: Dyrcz A., Werpachowski C. (red.) Przyroda Biebrzańskiego Parku Narodowego. Wyd. Biebrzański Park Narodowy, Osowiec-Twierdza: 247- 255.
- Wohlgemuth E. 1986. Nový druh ryby v našich vodach - střevlička východni (Pseudorasbora parva). Československe Rybarstvi 3: 114-116.
- Wohlgemuth E., Šebela M. 1987. Střevlička východni, nový prvek evropské ichtyofauny. Živa 35: 25-27.
- Xie S., Cui Y., Li Z. 2001. Dietary-morphological relationships of fishes in Liangzi Lake, China. Journal of Fish Biology 58: 1714-1729.
- Žitnan R., Holčik J. 1976. On the first find of Pseudorasbora parva in Czechoslovakia. Zoologicke Listy 25: 91-95.
| | | | | | Streszczenie | | The species originates from the East-Asiatic subregion, including the drainage basins of Amur, Yang-tze, and Huang-ho, Japanese islands, western and eastern parts of Corean peninsula and Taiwan. It was accidentally carried beyond the natural range with herbivorous fish, mainly from the territory of China. In Europe (Romania, Albania) Stone Morocco was found for the first time in 1961. In all probability in those times it already occurred in the Volga, Don and Dniestr rivers. From these places it spontaneously colonized almost the whole area of Europe, Asia Minor and North Africa owing to accidental introductions.
In Poland it was found for the first time in the Stawno fish farm near Milicz. It was introduced there earlier (1987?) with stocking material of carp and other herbivorous fish from Hungary or Czech. From that place it has probably spread to other fish farms, from where it made its way into open waters.
Currently it has a wide, insular distribution in Poland, mainly in central and lowland regions where it inhabits fish ponds, small reservoirs, lakes and rivers, including small water courses and drainage ditches.
Occurring in masses, it competes for food with bred fish species, mainly with Carp. In open waters, following the appearance of Stone moroco, the decline of some autochtonous fish species (Scardinius erythrophthalmus, Carassius carassius, Rhodeus sericeus, Gobio gobio, Leucaspius delineatus) was noted. It was connected with competition for food and foraging on the spawn and juvenile stages of the species mentioned. Stone Morocco may be also a vector of infection diseases caused by Sphaerothecum destruens.
On account of the numerous occurrence of this species in many regions of Europe and its specific biology (high reproduction rate - spawning is multi-litter; parental care for spawned eggs), elimination or reduction of the numbers of P. parva is practically impossible in open waters. | | | | | | Opracowanie | | Andrzej Witkowski | | | | |
|