
Mustela vison Schreber, 1777
norka amerykańska
American Mink |   | Rodzina | | Mustelidae łasicowate | | Rząd | | Carnivora drapieżne | | Gromada | | Mammalia ssaki | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
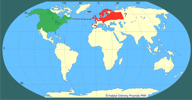
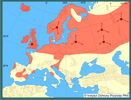
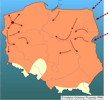 | | | | | | Pierwotna ojczyzna gatunku | | Naturalny zasięg występowania obejmował Amerykę Północną bez obszarów silnie wysuniętych na północ kontynentu (Hall 1981). | | | | | | Podstawowe cechy morfologiczne | | Norka amerykańska to średniej wielkości drapieżnik o wyraźnie zaznaczonym dymorfizmie płciowym. Długość głowy i tułowia samców waha się od 33 do 45 cm przy średniej wadze 1,2 (0,6-1,7) kg, samic zaś od 31 do 38 cm, jednakże są one o połowę lżejsze (0,4-0,8 kg). Gęsta, wodoodporna sierść jest jednym z przystosowań do ziemno-wodnego trybu życia. Ubarwienie przeważnie ciemnobrązowe, prawie czarne z brązowym odcieniem, często z rozmaicie rozmieszczonymi niewielkimi białymi plamami na podbródku, gardle lub brzuchu, a niekiedy również na łapach. Kilka procent populacji stanowią osobniki ubarwione popielato w różnych odcieniach. W warunkach fermowych wyhodowano ponad 70 odmian barwnych. | | | | | | Biologia, ekologia | | Gatunek ziemno-wodny, doskonale pływa i nurkuje, na lądzie szybko biega, wspina się po drzewach. Norka aktywna jest w różnych porach doby, najczęściej jednak o zmierzchu i nocą. Zasiedla różne środowiska, preferuje sąsiedztwo wszelkiego rodzaju cieków i zbiorników wodnych: rzek, kanałów melioracyjnych, jezior, stawów i wybrzeży morskich, pojawia się także wśród osad ludzkich. W zasobnych siedliskach osiąga zagęszczenie do 20 osobników na 10 km cieku wodnego. Na schronienia wybiera dziuple, nory, zajęte lub opuszczone żeremia bobrów, stosy kamieni, najczęściej te, które położone są w pobliżu wody. Jej spektrum pokarmowe jest bardzo szerokie (Sidorovich 1992), zmienne sezonowo; zależy również od środowiska, liczebności ofiar w danym środowisku i od płci; większe i cięższe samce polują na ofiary większe aniżeli samice (Birks i Dunstone 1985; Jędrzejewska i in. 2001). Norka zwykle poluje na ofiary najłatwiej dostępne; w jej pokarmie dominują gryzonie (norniki, niekiedy piżmak i karczownik ziemnowodny), ptaki, ryby, płazy i raki. Okazjonalnie zjada także bezkręgowce i rośliny. Areał osobniczy samca zazwyczaj pokrywa się z areałami kilku samic, a w zasobnych w pokarm siedliskach może także zachodzić na terytoria innych samców. W kwietniu-maju samica rodzi 1-6 młodych, które do jesieni pozostają z matką, a już wiosną mogą przystępować do rozrodu. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Norka ze względu na gęste, trwałe futro nabrała znaczenia gospodarczego w XIX wieku. Stała się bardzo atrakcyjnym gatunkiem fermowym. W latach 20. XX wieku fermy norek zaczęły powstawać w wielu krajach europejskich. Uciekające z ferm osobniki zapoczątkowały powstanie dzikiej populacji rozmnażającej się na wolności. Gatunek rozpoczął kolonizację Europy od Skandynawii, Wysp Brytyjskich i Rosji. Ponadto w latach 1933-1977 na terenie byłego ZSRR rozpoczęto aklimatyzację i wypuszczono na wolność około 21 300 osobników norki. W latach 50. XX w. na Białorusi introdukowano 865 norek amerykańskich, a ich liczebność pod koniec lat 80. szacowano już na 56 000 (Czesnokov 1989; Sidorovich 1993). Norkę amerykańską uznano za wydajniejszą w hodowli i cenniejszą pod względem jakości futra od rodzimej norki europejskiej Mustela lutreola (Linnaeus, 1761). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | W Polsce pierwsze hodowle norek amerykańskich powstały w roku 1953 (Lisiecki i Sławoń 1980), a już wkrótce zaobserwowano pierwszych pojedynczych uciekinierów i sporadyczne przypadki rozrodu tego gatunku poza hodowlą (Ruprecht 1996). Do lat 70. obserwacje norek były sporadyczne i pochodziły z północnej i wschodniej części Polski (Pomorze, Pojezierze Warmińsko-Mazurskie, Podlasie, Mazowsze). Prawdopodobnie były to nie tylko zwierzęta zbiegłe z niewoli, głównie na Pomorzu Zachodnim, ale i pojedynczy imigranci zza białoruskiej granicy (Brzeziński, Marzec 2003). Na początku lat 80. obserwacje stały się liczniejsze, pochodziły najczęściej z dolin rzecznych Narwi, Biebrzy, Supraśli, z Mazur, Suwalszczyzny i Podlasia (Ruprecht i in. 1983; Romanowski i in. 1984; Żurowski, Kammler 1987; Ruprecht 1996). Z tego okresu pochodzą również pierwsze obserwacje z Mazowsza, z okolic Warszawy (Romanowski i in. 1984) oraz Pomorza Zachodniego (Ruprecht 1996). W latach 80. kolonizacja terenu Polski nabrała tempa i gatunek zajął kolejne rejony kraju, należące dziś do województw: kujawsko-pomorskiego, wielkopolskiego, lubuskiego i dolnośląskiego. Do końca lat 90. norka amerykańska skolonizowała niemal cały obszar Polski. Nie stwierdzono jej obecności jedynie na Opolszczyźnie, Roztoczu i w Bieszczadach.
Drogi inwazji norki amerykańskiej prowadzą głównie dolinami rzecznymi; z północnego wschodu kraju rozszerzała ona swój zasięg wzdłuż dolin Narwi, Wisły, Bugu i Sanu. Prawdopodobnie w tym samym czasie miało miejsce przenikanie osobników z północno-zachodniej części kraju dolinami Odry, Warty i Pilicy, aż po pas pogórzy (Brzeziński i Marzec 2003). | | | | | | Występowanie na terenach chronionych | | Badania ankietowe przeprowadzone w 23 polskich parkach narodowych potwierdziły występowanie norki amerykańskiej na terenie 8 z nich, w pozostałych 15 norki nie stwierdzono lub brak na jej temat danych (Błoszyk i in. 2005). Biorąc pod uwagę aktualne rozmieszczenie norki w Polsce zasiedla ona przynajmniej takie parki narodowe jak: Białowieski i Biebrzański PN, PN Bory Tucholskie, Drawieński, Narwiański, Woliński i Słowiński PN, PN "Ujście Warty". Najprawdopodobniej zasiedla też wszystkie polskie parki krajobrazowe zasobne w cieki wodne od pogórzy po Bałtyk. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Wkrótce po opanowaniu części Europy norka amerykańska zaczęła uchodzić za gatunek bardzo destrukcyjny dla rodzimych zoocenoz, wręcz wyniszczający lokalne populacje niektórych ptaków i ssaków (Żebrowski 1987). Jej oddziaływanie najdotkliwiej zaznaczyło się na wyspach, szczególnie u wybrzeży Wielkiej Brytanii i na dużych jeziorach, gdzie wcześniej nie występowała norka europejska, a gdzie jej amerykański krewniak przyczynił się do wyniszczenia lub spadku liczebności kolonijnie gnieżdżących się mew, rybitw oraz karczownika ziemnowodnego (Craik 1990 1995, 1998; Macdonald i Strachan 1999, Clode i Macdonald 2002). Wiosną i latem ptaki są znacznie bardziej wrażliwe na drapieżnictwo niż podczas migracji i zimowania. Podczas inkubacji i wodzenia młodych samice ograniczają swoją aktywność. Ponadto samice kaczek, gęsi, łysek i perkozów podczas wychowu piskląt pierzą się na kilka tygodni, tracąc zdolność lotu i stając się wówczas bezbronne wobec drapieżników; stąd wysoki udział ptaków w diecie norek w sezonie lęgowym, zazwyczaj dużo wyższy niż w innych porach roku (Arnold i Fritzell 1987, Niemimaa i Pokki 1990, Brzeziński i Żurowski 1992, Lodé 1993). W Parku Narodowym "Ujście Warty" wiosną ptaki stanowią 46-60% biomasy zjadanych ofiar norki amerykańskiej (Bartoszewicz 2003). Na jeziorach mazurskich udział ptaków stanowi w pokarmie norki kilkanaście procent zjadanej biomasy ofiar (Brzeziński 1998), podczas gdy w Puszczy Białowieskiej ptaki są śladowym (do 2,4%) komponentem diety norki (Jędrzejewska i Jędrzejewski 1998). Dane uzyskane w ujściu Warty wskazują, że choć ptaki stanowią bardzo istotny składnik diety norki amerykańskiej, to przy dużych zagęszczeniach ptaków zagrożenie ze strony norki, nawet licznie występującej, nie jest duże (Bartoszewicz 2003). Może ona jednak obniżać sukces lęgowy niektórych gatunków mniej licznie zasiedlających mokradła i zbiorniki wodne i - wraz z innymi czynnikami - przyczyniać się do spadku ich liczebności. Do głównych ofiar norki amerykańskiej należą też ssaki (20-40% - wg danych europejskich), ryby (10-40%) i płazy (15-50%). Spośród ssaków norka najchętniej poluje na norniki, w Ameryce Północnej także na piżmaki Ondatra zibethicus (Arnold i Fritzell 1987, Soper i Payne 1997). W Europie natomiast piżmak jedzony jest w niewielkiej ilości (do kilku procent składu diety - Niemimaa i Pokki 1990, Brzeziński i Żurowski 1992, Sidorovich 1992, Lodé 1993, Maran i in. 1998, Sidorovich i in. 1998), co wynika z niskiej liczebności tego gryzonia w środowiskach europejskich. Jednak w PN "Ujście Warty", gdzie piżmak (gatunek w Polsce obcy) występuje stosunkowo licznie, jest on jedną z ważniejszych ofiar norki; na terenie zalewowym jesienią ostatnich lat stanowił do 29% biomasy ofiar (Bartoszewicz 2003). W Anglii natomiast stwierdzono bardzo silny wpływ norki amerykańskiej na populacje karczownika Arvicola terrestris (Barreto i in. 1998, Macdonald i Strachan 1999). Również na Białorusi (Macdonald i in. 2002) zaraz po pojawieniu się w tym kraju norki amerykańskiej odnotowano spadek liczebności karczownika. Obecnie, ze względu na bardzo niską liczebność tego gryzonia na wielu obszarach Europy, stanowi on niewielki składnik diety norki; w PN "Ujście Warty" jest to zaledwie 0,16-2,4% biomasy zjadanych przez nią ofiar. Natomiast bardzo ważnym elementem diety norki amerykańskiej są tu ryby, których udział w jej zimowym pokarmie dochodzi do 60% biomasy.
W ujściu Warty w latach 1978-1980, a więc przed pojawieniem się norki amerykańskiej, sukces lęgowy krzyżówek Anas platyrhynchos zakładających gniazda w budkach i koszach wynosił 31-49% (Majewski 1986); w latach 1994-1998, czyli po pojawieniu się norki, ok. 50% (Kuczyński 1999), a w latach 1998-1999 - ok. 48% (Bartoszewicz 2003), znaczy to, że sukces rozrodczy kaczki pozostaje na wcześniejszym poziomie, tym sprzed przybycia norki amerykańskiej do zachodniej Polski, a drapieżnik ten nie oddziałuje zbyt znacząco na reprodukcję tak licznie występujących kaczek. Bardziej wrażliwe na drapieżnictwo norki okazały się lęgi gęsi gęgawy Anser anser. Sukces lęgowy gęgawy na sztucznych platformach gniazdowych w PN "Ujście Warty" wynosił ostatnio zaledwie 13,6%. Zaobserwowano też wzrost drapieżnictwa norek w koloniach mew Larus spp. u ujścia Warty (Bartoszewicz 2003). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Norka amerykańska zmienia istotnie strukturę lokalnych zoocenoz, ale też wpływa na stan populacji interesujących gospodarkę łowiecką i rybacką. Skala tych oddziaływań i zagrożeń nie jest dostatecznie rozpoznana.
Próby eksperymentalnego usuwania norek amerykańskich z wysp, m.in. w ramach programu ochrony norki europejskiej, podjęto na wyspach bałtyckich i położonych wokół Szkocji (Craik 1998; Nordström i in. 2002, Nordström i in. 2003, T. Maran - mat. niepubl.). Na norki polowano ze szkolonymi psami, zastawiano żywołowne pułapki, a następnie zwierzęta zabijano. W rezultacie tych doświadczeń stwierdzono, że na wyspach - gdzie usunięto norki - rosła produktywność kolonii małych gatunków mew i rybitw (Craik 1998). Także na wyspach Bałtyku stwierdzono, że po usunięciu norek populacja niektórych gatunków (np. rybitwy czubatej Sterna sandvicensis, kamusznika Arenaria interpres) odbudowała się stosunkowo szybko, wzrastając z roku na rok, podczas gdy ptaki alkowate Alcidae potrzebują dłuższego okresu na odbudowę liczebności (Nordström i in. 2003). Okazało się, że usunięcie norki nawet z rozległych archipelagów wysp jest możliwe, jednak konieczne jest stałe prowadzenie działań łowieckich. Jako metodę redukcji liczebności drapieżników zaproponowano też kontrolę płodności (Tuyttens i Macdonald 1998) poprzez podawanie środków antykoncepcyjnych lub usuwanie samic w okresie rozrodczym (Macdonald i Strachan 1999). Usuwanie norek było tym bardziej efektywne, im wyspy były bardziej izolowane i oddalone od stałego lądu (Nordström i in. 2002). Podjęcie działań zmierzających do ograniczenia liczebności norki przynajmniej z niektórych cennych przyrodniczo terenów ma sens o tyle, o ile daje szanse w miarę trwałego powodzenia. Jednakże nadal rozwijająca się w Polsce hodowla fermowa norek stwarza realne niebezpieczeństwo ciągłego wydostawania się na wolność nowych osobników. Praktyka dowodzi, że skuteczne zapobieganie ucieczkom zwierząt z ferm jest niewykonalne. Można jedynie podjąć próbę ograniczenia liczebności poprzez polowanie lub chwytanie i zabijanie, ale takie działania musiałyby być prowadzone permanentnie. W ostatnich latach, w następstwie prawnych ograniczeń hodowli fermowej norek amerykańskich wprowadzonych w krajach Europy Zachodniej, hodowcy spoza Polski zaczęli inwestować w rozwój ferm zwierząt futerkowych w Polsce w pobliżu zachodniej granicy państwa. W efekcie, w bezpośrednim sąsiedztwie Parku Narodowego "Ujście Warty" (w odległości 20 km od jego granic) funkcjonuje pięć ferm norek, w których obsada wynosi ponad 260 000 zwierząt.
Sztuczne gniazda (budki lęgowe dla kaczek, platformy lęgowe dla innych ptaków) stosowane na niektórych terenach jako metoda aktywnej ochrony, służąca zwiększeniu udatności lęgów i/lub zapewnieniu dodatkowych miejsc lęgowych, po pojawieniu się norki amerykańskiej okazały się dla ptaków pułapką. Widoczne z daleka, umieszczone wysoko nad powierzchnią wody lub gruntu są dużo łatwiej wykrywalne przez drapieżnika niż gniazda naturalne. Na terenach podmokłych sztuczne gniazda dla lądowego drapieżnika stają się często atrakcyjnymi kryjówkami.
Do roku 2001 norka amerykańska nie była objęta polskimi uregulowaniami prawnymi. Na listę zwierząt łownych została wprowadzona dopiero na mocy Rozporządzenia Ministra Środowiska z dnia 10 kwietnia 2001 r. (Dz. U. 2001, nr 43, poz. 488). Na mocy nowego Rozporządzenia Ministra Środowiska z dnia 16 marca 2005 (Dz. U. 2005, Nr 48, poz. 459) polowanie dozwolone jest od 1 lipca do 31 marca, a na terenie obwodów łowieckich, w których występuje głuszec Tetrao urogallus i cietrzew T. tetrix oraz na terenach rybackich obrębów hodowlanych - przez cały rok. | | | | | | Prognoza | | W dobrze kontrolowanym terenie, jakim jest ujście Warty, w latach 1996-2000 obserwowano szybki przyrost lokalnej populacji norki, po czym populacja osiągnęła maksymalną liczebność, a następnie jej liczebność nieco spadła (Bartoszewicz 2003). Podobny trend zaobserwowano w innych rejonach Polski (A. Zalewski - mat. niepubl.). Wiele wskazuje więc na to, że lokalnie krajowa populacja zaczyna się stabilizować. Jednakże w obliczu rozwijającej się dynamicznie hodowli fermowej norek, szczególnie w zachodniej Polsce, i przy stałym zasilaniu lokalnych populacji nowymi uciekinierami, należy się liczyć z umocnieniem się tego wszechstronnego drapieżnika w Polsce, z całymi konsekwencjami jego ekologicznej roli. | | | | | | Literatura | | - Arnold T.W., Fritzell E.K. 1987. Food habits of prairie mink during the waterfowl breeding season. Canadian Journal of Zoology 68: 2322-2324.
- Arnold T.W., Fritzell E.K. 1989. Habitat use by male mink in relation to wetland characteristics and avian prey abundances. Canadian Journal of Zoology 68: 2205-2206.
- Barreto G.R., Rushton S.P., Strachan R., Macdonald D.W. 1998. The role of habitat and mink predation in determining the status and distribution of water vole in England. Animal Conservation 1: 129-137.
- Bartoszewicz M. 2003. Wpływ norki amerykańskiej Mustela vison na ptaki wodne a strategia ich ochrony w Parku Narodowym "Ujście Warty". Praca doktorska. Instytut Ochrony Przyrody PAN, Kraków.
- Birks J.D.S., Dunstone N. 1985. Sex related differences in the diet of the mink Mustela vison. Holarctic Ecology 8: 245-252.
- Błoszyk J., Walkowiak M., Zgrabczyńska E. 2005. American mink in polish national parks. Abstracts of international conference: Mammals - synantropic, synurbic, alien and invasive species. Poznań: 13.
- Brzeziński M., Żurowski W. 1992. Spring diet of the American mink in the Mazurian and Brodnica Lakelands in Poland. Acta Theriologica 37 (1-2): 193-198.
- Brzeziński M. 1998. Biocenotyczna funkcja norki amerykańskiej Mustela vison w strefie pobrzeża jeziornego. Praca doktorska. Zakład Ekologii Uniwersytetu Warszawskiego, Warszawa.
- Brzeziński M., Marzec M. 2003. The origin, dispersal and distribution of the American mink Mustela vison in Poland. Acta Theriologica 48 (4): 505-514.
- Clode D., Macdonald D. W. 2002. Invasive predators and the conservation of island birds: the case of American Mink Mustela vison and terns Sterna spp. in the Western Isles, Scotland. Bird Study 49: 118-123.
- Craik J.C.A. 1990. The price of mink. Scottish Bird News 19: 4-5.
- Craik J.C.A. 1995. Effects of North American mink on the breeding success of terns and smaller gulls in west Scotland. Seabird 17: 3-11.
- Craik J.C.A. 1998. Recent mink-related declines of gulls and terns in west Scotland and the beneficial effects of mink control. Argyll Bird Report 14: 98-110.
- Czesnokov N.I. 1989. Dzikije zywotnyje mieniajut adriesa. Mysl, Moskwa: 1-219.
- Jędrzejewska B., Jędrzejewski W. 1998. Predation in vertebrate communities. The Białowieża Primeval Forest as a case study. Springer-Verlag, Berlin, Heildelberg, New York: 1-450.
- Hall E.R. 1981. The mammals of North America. II. John Wiley and Sons Inc., New York: 1-1181.
- Jędrzejewska B., Sidorovich V.E., Pikulik M.M., Jędrzejewski W. 2001. Feeding habits of the otter and the American mink in Białowieża Primeval forest (Poland) compared to other Eurasian population. Ecography 24: 165-180.
- Kuczyński L. 1999. Biologia rozrodu kaczki krzyżówki Anas platyrhynchos w Rezerwacie Słońsk. Praca doktorska, Uniwersytet im. A. Mickiewicza, Poznań.
- Lisiecki H., Sławoń J. 1980. Hodowla norek. Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa: 1-309.
- Lodé T. 1993. Diet composition and habitat use of sympatric polecat and American mink in western France. Acta Theriologica 38: 161-166.
- Macdonald D.W., Strachan R. 1999. The Mink and the water vole. Analyses for conservation. Wildlife Conservation Research Unit, Oxford: 1-161.
- Macdonald D.W., Sidorovich V.E., Anisimova E.I., Sidorovich N.V., Johnson P.J. 2002. The impact of American mink Mustela vison and European mink Mustela lutreola on waterf voles Arvicola terrestris in Belarus. Ecography 25 (3): 295-302.
- Majewski P. 1986. Breeding ecology of the Mallard on a flooded area of the Warta river mouth, Poland. Wildfowl 37: 88-103.
- Niemimaa J., Pokki J. 1990. Food habits of the mink in the outer archipelago of the Gulf of Finland. Suomen Riista 36: 18-30.
- Nordström M., Högmander J., Nummelin J., Laine J., Laanetu N., Korpimäki E. 2002. Variable responses of waterfowl breeding populations to long-term removal of introduced American mink. Ecography 25 (4): 385-394.
- Nordström M., Högmander J., Laine J., Nummelin J., Laanetu N., Korpimäki E. 2003. Effects of feral mink removal on seabirds, waders and passerines on small islands in the Baltic Sea. Biological Conservation 109 (3): 359-368.
- Romanowski J., Kaszuba S., Koźniewski P. 1984. Nowe dane o występowaniu norek (Mustela lutreola, M. vison) w Polsce. Przegląd Zoologiczny 28: 221-223.
- Ruprecht A.L. 1996. Materiały do rozmieszczenia przedstawicieli podrodzaju Lutreola Wagner 1841 (Carnivora: Mustelidae) w Polsce. Przegląd Zoologiczny 40: 223-233.
- Ruprecht A., Buchalczyk T., Wójcik J.M. 1983. Występowanie norek (Mustela vison) w Polsce. Przegląd Zoologiczny 27: 87-99.
- Sidorovich V.E. 1992. Comparative analysis of the diets European mink (Mustela lutreola), American mink (M. vison) and polecat (M. putorius). Small Carnivore Conservation 6: 2-4.
- Sidorovich V.E. 1993 Reproductive plasticity of the American mink Mustela vison in Belarus. Acta Theriologica 38 (2): 175-183.
- Sidorovich V., Kruuk H., Macdonald D.W., Maran T. 1998. Diets of semi-aquatic carnivores in northern Belarus, with implications for population changes. In: Dunstone N., Gorman M.L. (eds) Behaviour and ecology of riparian mammals. Cambridge University Press, Cambridge: 177-190.
- Soper L.R., Payne N.F. 1997. Relationship of introduced mink, an island race of muskrat, and marginal habitat. Annales Zoologici Fennici 34: 251-258.
- Tuyttens F.A.M., Macdonald D.W. 1998. Fertility control: an option for non-lethal control of wild carnivores? Animal Welfare 7: 339-364.
- Żebrowski J. 1987. Norka północno-amerykańska w Puszczy Białowieskiej. Łowiec Polski 2: 8.
- Żurowski W., Kammler J. 1987. Norka amerykańska (Mustela vison Schreber, 1777) w stanowiskach bobrów. Przegląd Zoologiczny XXXI, 4: 513-520.
| | | | | | Streszczenie | | American Mink is a semi-aquatic species from North America, excluding the northern part of the continent. Because of its dense fur American Mink has become a very important fur-bearing species since the 19th century. During the 1920s in many European countries the first fur farms were established and individuals that escaped from those farms established a free-living population. American Mink has begun colonizing Europe from Scandinavia, United Kingdom and Russia. In addition, between 1933 and 1977 more than 21.000 individuals were acclimatized and released in the former Soviet Union. In Poland the first mink fur farms were established in 1953. Up to 1970 minks were rather infrequent and recorded only in northern and eastern Poland. In the 1980s colonization of our country by American Mink speeded up and the species enlarged its range towards west. Up to the end of the 1990s American Mink colonized almost the whole of Poland. Presently, it doesn't occur only in the southern part of the country. Soon the wild population of American Mink proved to have a very destructive impact on some local population of birds and mammals.
American Mink is an excellent swimmer, runner and tree climber. It occupies a wide range of habitats and prefers the vicinity of various water courses and reservoirs, including the seashore. It appears also in the neighbourhood of human settlements. It is a generalist predator and its diet changes depending on season. Usually, American Mink hunts on the most accessible species; the main prey includes mammals (20-40% of the biomass consumed), fish (10-40%) and amphibians (15-50%). Birds may be a dominant component of Mink's diet during the breeding season reaching up to 60% of the biomass. Mink's most negative impact on European fauna occurs on islands, especially along the British coast, and on big lakes, where the mink caused extermination or a decrease in numbers of birds nesting in colonies (especially gulls and terns) as well as water voles.
Experimental Mink population control and eradication were undertaken on the Baltic and British islands. Predator removal is possible even on archipelagos but long-term trapping is necessary. In some valuable terrains there is a need to undertake actions leading to a reduction in mink numbers, but only if there is a chance of success. The dynamic development of fur farming in Poland creates a permanent risk of escaping of new individuals. Practically, an effective prevention against escapes is impossible. In 1996-2000 a considerable increase in Mink number was observed in Poland. Next, the population probably reached a maximum level and decreased. The Polish population of American Mink is now probably stable. Taking into consideration the development of farm production, especially in the western part of Poland, and owing to the constant inflow of new escaping minks, one can expect the population of this predator to strengthen in Poland with all its consequences. | | | | | | Opracowanie | | Magdalena Bartoszewicz i Andrzej Zalewski | | | | |
|