
Hyphantria cunea (Drury,1773)
oprzędnica jesienna
Fall Webworm, American White Moth |   | Rodzina | | Arctiidae niedźwiedziówkowate | | Rząd | | Lepidoptera motyle | | Gromada | | Insecta owady | | Typ | | Arthropoda stawonogi | | |
 | |  | | | | | | | | |
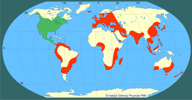
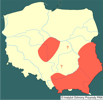 | | | | | | Pierwotna ojczyzna gatunku | | Ameryka Północna. | | | | | | Podstawowe cechy morfologiczne | | Motyl o rozpiętości skrzydeł 25-30 mm; przednie skrzydła barwy białej z ciemnymi plamkami ułożonymi w kilku rzędach, skrzydła tylne także białe z małą czarną plamką w części przedniej. Gąsienice oprzędnicy jesiennej silnie owłosione, ubarwione żółto-pomarańczowo, osiągają ponad 3 cm długości, żerując uszkadzają liście wielu roślin uprawnych, a także drzew i krzewów. | | | | | | Biologia, ekologia | | Oprzędnica jesienna może żyć na wielu gatunkach drzew leśnych i owocowych; liczba żywicieli przekracza 250. Rozwój gąsienic najlepiej przebiega na morwie, klonie jesionolistnym, klonie zwyczajnym, jabłoniach, gruszach, wiśniach i czereśniach oraz śliwach. Słabszy nieco rozwój ma miejsce na orzechu włoskim, winorośli, bożodrzewie i chmielu. Szkodnik rozprzestrzenia się głównie dzięki naturalnym przelotom dorosłych motyli i dzięki temu przeniknął na nowe tereny w wielu krajach. Także międzynarodowa wymiana towarowa może sprzyjać jego ekspansji. Pojedyncze osobniki mogą być introdukowane na przewożonych wegetatywnych częściach roślin żywicielskich, na ich opakowaniach, a także w opróżnionych już pojazdach. Zdolność gąsienic do przeżywania okresu do dwóch tygodni bez pokarmu umożliwia, że mogą one być przewiezione pojazdami samochodowymi na odległe tereny i tam dać początek nowemu ognisku. Obserwowano masowe migracje gąsienic, jak również przeloty motyli, będące wynikiem wyczerpania zasobów pokarmowych lub poszukiwania nowych siedlisk na terenach zurbanizowanych, na których obsiadały słupy telefoniczne, ściany domów, nawierzchnie dróg lub samochody, którymi mogły być przewożone na duże odległości (Giovanni i in. 1986). Introdukcja gąsienic lub motyli może następować także pociągami towarowymi z transportowanym na duże odległości drewnem, gdyż mogą one ukrywać się w spękaniach kory lub w otworach w pniach (Shu i Yu 1984). Istnieje także niewielka możliwość zawleczenia jaj lub gąsienic oprzędnicy przez entomologów amatorów. | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Po drugiej wojnie światowej oprzędnica została zawleczona z Ameryki Północnej do Europy środkowej (Węgry, Austria, b. Jugosławia), skąd następnie opanowywała kolejne kraje. Pod koniec XX wieku notowana była na obszarze od Francji po Ukrainę i od Danii po Italię, Grecję i Turcję (Buszko i Nowacki 2000). W połowie XX wieku uważano, że H. cunea rozprzestrzeni się na obszarze od Węgier do Niemiec i stanie się tam poważnym szkodnikiem. Jednakże to nie nastąpiło, głównie z powodu wysokich wymagań termicznych koniecznych dla przezimowania (Braasch 1976). Niska temperatura nie pozwala liczebniejszej populacji na osiągnięcie rozwoju koniecznego dla stadium diapauzy i tylko nielicznym osobnikom udaje się przezimować. Kolejny masowy pojaw może mieć miejsce w przypadkach introdukcji z innych obszarów. Kwarantannowy status oprzędnicy ma częściowo charakter historyczny, gdyż szkodnik ten został zawleczony do Europy stosunkowo niedawno i uważano iż będzie stwarzał duże zagrożenie. Jednakże czterdziestoletni okres obserwacji może stanowić podstawę do zrewidowania tego poglądu. Oprzędnica była notowana np. na terenie Austrii, ale nie wyrządzała tam szkód (OEPP/EPPO 1974, Boehm 1976). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | W Polsce przed 1960 r. odnotowano oprzędnicę w Małopolsce (Buszko i Nowacki 2000), a w następnych dekadach sporadycznie stwierdzana bywała w środkowej części kraju (woj. łódzkie) i południowo-wschodnich rejonach (woj. lubelskie i podkarpackie). Mimo kilkakrotnych przypadków zawleczenia, nie wykazuje na razie większych tendencji ekspansyjnych, być może nie znajduje jeszcze u nas odpowiednich warunków rozwoju. | | | | | | Występowanie na terenach chronionych | | Brak informacji. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Oprzędnica jesienna jest uznawana za groźnego szkodnika upraw roślinnych. Gatunek ten figuruje od wielu lat na listach kontrolowanych agrofagów (OEPP/EPPO 1957, 1974, 1980, 1990; Williams i in. 1987). Jej gąsienice powodują szybkie gołożery liściastych drzew leśnych oraz drzew owocowych. Doświadczalnie wykazano, że gąsienica szóstego stadium spożywa dziennie 435 mm2 świeżych liści jesionu natomiast gąsienica siódmego stadium uszkadza aż 814 mm2 (Jarfas i Miklos 1986). Grupowy sposób żerowania gąsienic w gniazdach powstałych z połączonych oprzędem liści doprowadza do gołożerów.
Zwalczanie polega na mechanicznym niszczeniu gniazd oraz stosowaniu insektycydów. W b. ZSRR dobre wyniki zwalczania H. cunea uzyskiwano stosując diflubenzuron (Sazonov i in. 1984) jak również fenwalerat i cypermetrynę, uzyskując w doświadczeniach laboratoryjnych 100% śmiertelność gąsienic (Sikura i in.1988). Jednakże przy chemicznym zwalczaniu odnotowano także bardzo niekorzystne działania uboczne. We Włoszech, gdzie H. cunea szczególnie preferuje morwę (Montermini i Oliva 1984; Ferrari i Trevisan 1987), zarówno stosowanie chemicznych insektycydów, jak i biologicznego zwalczania przy użyciu Bacilllus thuringiensis, było przyczyną masowych padnięć gąsienic jedwabnika morwowego (Bombyx mori), dla których liście morwy stanowią wyłączny pokarm w hodowlach.
Biologiczne zwalczanie oprzędnicy, to przede wszystkim stosowanie preparatów bakteryjnych ze wspomnianym Bacillus thuringiensis, które okazały wysoką skuteczność na Węgrzech i w Korei (Jasinka 1984; Choi i in. 1986). Badano także przydatność pułapek feromonowych (Chalcote i Gentry 1973), a także wykorzystanie owadobójczych grzybów Beauveria bassiana i B. globulifera (Jasinka 1984) oraz kruszynka Trichogramma dendrolimi, pasożyta jaj oprzędnicy (Shu i Yu, 1985) i innych parazytoidów (Morris 1976). Owadobójcze nicienie także mogą ograniczać liczebność populacji oprzędnicy (Yamanaka i in.1986). | | | | | | Prognoza | | Duże znaczenie gospodarcze Hyphantria cunea ma nadal w południowo-wschodniej Europie: w Bułgarii, Rumunii, na Ukrainie i w niektórych innych rejonach b. ZSRR (Yaroshenko 1975, Uchakina i Kalyzhnyi 1985) oraz b. Jugosławii, a ostatnio także we Włoszech. Wprawdzie na Węgrzech szkodliwość tego gatunku zmalała to jednak nadal stanowi on zagrożenie dla sadów.
Ponieważ motyl ten do niedawna nie miał możliwości wyrządzania większych szkód w lasach i sadach, z tego względu uznano, że H. cunea nie jest już w stanie poszerzyć swego areału oraz wyrządzać większe szkody niż to obserwujemy obecnie w Europie, a jego kwarantannowy status może być w przyszłości dyskusyjny. Jednak - wobec globalnego ocieplenia - nie można też wykluczyć odwrotnej sytuacji, a mianowicie nagłego zwiększenia aktywności tego motyla w Europie środkowej w najbliższych latach. | | | | | | Literatura | | - Boehm H. 1976. 25 years of Hyphantria cunea and Ceratitis capitata in Austria. In: Faber W. (ed.), Land- und Forstwirtschaftliche Forschung in Oesterreich. Österreichischer Agrarverlag, Vienna, Austria. Band VII:. 81-88.
- Braasch D. 1976. On the overwintering potential of Hyphantria cunea in the GDR. Nachrichtenblatt für den Pflanzenschutz in der DDR 30: 223-225.
- Buszko J., Nowacki J. 2000. The Lepidoptera of Poland. A distributional checklist. Polish Entomological Monographs 1: 1-178.
- Chalcote V.R., Gentry C.R. 1973. Mating behaviour of fall webworms and atraction of male moths to trap baited with virgin females. Journal of Economic Entomology 66: 1006-1007.
- Choi Y.C., Lee S.W., Shin Y.H., Lee K.H. 1986. Studies on the mass production of Bacillus thuringiensis as a microbial insecticide. Research Reports of the Rural Development Administration, Plant Environment, Mycology and Farm Products Utilization, Korea Republic 28: 56-59.
- Ferrari R., Trevisan M. 1987. Control of Hyphantria cunea and repercussions on cultures of Bombyx mori. Informatore Fitopatologico 37, 55-58.
- Giovanni G. de, Oliva G., Montermini A. 1986. Defence strategy against Hyphantria cunea. Informatore Fitopatologico 36, 11-15.
- Jarfas J., Miklos V. 1986b. [Activity and nutrition of Hyphantria cunea, II]. Kerteszeti Egyetem Kozlemenyei 50: 251-258.
- Jasinka J. 1984. Farm studies on application techniques and pesticide efficiency against Hyphantria cunea. Növenyvedelem 20: 368-372.
- Montermini A., Oliva G. 1984. Let's get to know the fall webworm. Informatore Fitopatologico 34, 35-40.
- Morris R.F. 1976. Relation of parasite attack to the colonial habit of Hyphantria cunea. Canadian Entomologist 108: 833-836.
- OEPP/EPPO 1957. Fall webworm (Hyphantria cunea) in 1956. EPPO Publications Series A, No.19: .
- OEPP/EPPO 1974. Survey of the following quarantine pests and diseases: Heterodera rostochiensis, Hyphantria cunea, Leptinotarsa decemlineata, Quadraspidiotus perniciosus, Synchytrium endobioticum, Corynebacterium sepedonicum. EPPO Publications Series B, No. 77: 23-26.
- OEPP/EPPO 1980. Data sheets on quarantine organisms No.111, Hyphantria cunea.
- OEPP/EPPO Bulletin 11 (1): .
- OEPP/EPPO 1990. Specific quarantine requirements. EPPO Technical Documents No.1008: .
- Sazonov A.P., Karetnikova I.N., Novozhilov K.V. 1984. The sterilant effect of diflubenzuron using Hyphantria cunea as an example. In: Novozhilov K.V. (ed.) Regulyatory rosta i razvitiya nasekomykh v bor'be s sel'skokhozyaistvennymi vreditelyami. Vsesoyuznyi Nauchno-issledovatel'skii Institut Zaschity Rastenii, Leningrad, USSR: 54-58.
- Shu C.R., Yu C.Y. 1984. A preliminary report on quarantine and experimental control of Hyphantria cunea pupal stage. Forest Science and Technology Linye Keji Tongxun No. 9: 21-22.
- Shu C.R., Yu C.Y. 1985. An investigation on the natural enemies of Hyphantria cunea. Natural Enemies of insects Kunchong Tiandi 7: 91-94.
- Sikura A.I., Fedosov S.A., Vovk T.I. 1988. Synthetic pyrethroids in the control ofHyphantria cunea. Zashchita Rastenii No. 5: 40.
- Uchakina V.A., Kalyzhnyi V.G. 1985. Hyphantria cunea in the Rostov region. Zashchita Rastenii No. 7: 38.
- Williams M.L., Sheffer B.J., Miller G.L,. Hendricks H.J. 1987. Control of fall webworm. Research Report Series, Alabama Agricultural Experiment Station, Auburn University No. 5: 24.
- Yamanaka S., Seta K., Yasuda M. 1986. Evaluation of the use of entomogenous nematode, Steinernema feltiae (str. Mexican) for the biological control of the fall webworm, Hyphantria cunea (Lepidoptera: Arctiidae). Japanese Journal of Nematology 16: 26-31.
- Yaroshenko V.A. 1975. Particulars on the flight of Hyphantria cunea. Zashchita Rastenii 11: 53.
| | | | | | Streszczenie | | Fall Webworm Hyphantria cunea (Drury, 1773) is a moth of a wingspan of 25-30 mm; forewings and hindwings are white and covered by dark spots. After World War II, Fall Webworm was brought from North America to Central Europe (Hungary, Austria, former Yugoslavia), from where it has successively colonized other countries. At the end of the 20th century it was noted from France to Ukraine and from Denmark to Italy, Greece and Turkey. Foraging larvae of Fall Webworm caused damage to leaves of many cultivated plants, also forest and fruit trees; the number of its hosts exceeds 250. Since a long time this species is listed as a controlled agrophage. Fall Webworm caterpillars quickly defoliate deciduous forest trees and fruit trees. The pest spreads mainly owing to natural abilities; adults are good fliers. The facility of the larvae to withstand starvation up to 2 weeks means that they can be easily transported on vehicles to new sites and there initiate new infestations. Until 1960 Fall Webworm was noted in Małopolska and in the next decades it was sporadically mentioned from the central (Łódź) and south-eastern (Lublin and Podkarpacie) parts of the country. In spite of several introductions, it does not show greater tendency to spread; perhaps it does not find in our country conditions suitable for development. Control consists in mechanical destruction of nests and application of insecticides and biological preparations. Biological control with the use of Bacillus thuringiensis appeared to be highly effective in Hungary and Korea. The usefulness of feromone traps and insecticidal fungi, Beauveria bassiana and B. globulifera, and parasitoids was also tested. Insecticidal nematodes may also reduce numbers of this pest. Fall Webworm is still of high economic importance in south-eastern Europe: Bulgaria, Romania, Ukraine, in some regions of the former USSR, former Yugoslavia, and recently also in Italy. Though in Hungary the noxiousness of this species has decreased, it still poses a threat to orchards. Because until quite lately Fall Webwarm did not seriously affected forests and orchards, it was believed that this moth is unable to expand the area of occurrence and cause greater damage than currently observed in Europe, and that in the future its quarantine status could be controversial. However, in view of the global warming, one can not exclude an opposite phenomenon, i.e. a sudden growth of its activity in Central Europe. | | | | | | Opracowanie | | Mieczysław Kosibowicz | | | | |
|