
Neogobius melanostomus (Pallas, 1811)
babka bycza
Round Goby, Black Spotted Goby, Caspian Round Goby |   | Rodzina | | Gobiidae babkowate | | Rząd | | Perciformes okoniokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
 | | | | | | Pierwotna ojczyzna gatunku | | Do drugiej połowy XX wieku gatunek ten był uznawany za endemit rejonu ponto- kaspijskiego. Zasiedlał przybrzeżną strefę Morza Czarnego, Azowskiego, Kaspijskiego i Morza Marmara. Występował także w dolnych odcinkach rzek, będących częścią zlewni tych mórz. W rejonie Morza Czarnego, prócz strefy przybrzeżnej Neogobius melanostomus zasiedlał: Dunaj - od ujścia do Vidina, Vit - od ujścia do Pleviny, Kančija, Ropotam, Rezovskaja, Dniestr - od ujścia do Kamieńca Podolskiego, Južnyj Bug - od ujścia do górnego biegu, Dniepr wraz z dopływami - od ujścia do środkowego biegu, Don - od ujścia do Rostowa, Doniec oraz rzeki Półwyspu Krymskiego i Wybrzeża Kaukaskiego - Mezib, Pšada, Vulan, Kodor, Čoroch (Svetovidov 1964). W Morzu Kaspijskim bytuje w płytkich wodach u zachodnich, północnych i wschodnich wybrzeży tego morza w Azerbejdżanie, Rosji, Kazachstanie i Turkmenii. U brzegów Iranu jest nieliczny i nie ma go w głębokich partiach morza (Stepanova i in. 2002). | | | | | | Podstawowe cechy morfologiczne | | N. melanostomus jest rybą niewielką; samce z reguły są większe od samic, a maksymalna osiągana długość ryb zależy od miejsca ich życia. Berg (1949) podaje, że ryby te osiągają maksymalnie 25 cm długości. W Zatoce Gdańskiej najczęściej łowione są ryby z przedziału wielkości 14-18 cm: największy osobnik miał 24,6 cm długości całkowitej i ważył 322 gramy (Skóra i Stolarski 1993b).
Ubarwienie ciała tej babki jest zmienne - zależy od pory roku, siedliska, płci i fazy życia ryby. Zwykle jest to niejednolity odcień szarobrązowy lub oliwkowo-żółty z rzędem ciemnych plam po bokach ciała. Grzbiet jest ciemniejszy od pozostałej części tułowia. Dojrzałe płciowo samce w okresie tarła są zupełnie czarno-granatowe, z jaskrawożółtymi obrzeżami na skrajach płetw nieparzystych. Samice zasadniczo nie zmieniają swojego ubarwienia, do pewnego stopnia wpływa na nie jedynie tło siedliska. Charakterystyczną dla ryb tego gatunku jest czarna plama występująca w tylnej partii płetwy grzbietowej D1 między promieniami IV a VI. U młodych brzeg plamy jest jaśniejszy. Zrośnięte płetwy brzuszne tworzą charakterystyczną przyssawkę stanowiącą 0,6-0,8 długości brzucha. Wysokość płetwy ogonowej jest krótsza od jej długości o 1/3. Długość głowy równa jest szerokości lub jest nieco mniejsza. Granica szczęk dosięga pierwszej ćwiartki oka. Dolna szczęka nie wystaje przed górną. N. melanostomus posiada górne i dolne zęby gardłowe, przy czym te ostatnie są mniejsze od przednich (Pinchuk 1991, Bogachik 1967). Obecność powierzchniowych neuromastów (brak kanałów linii nabocznej) czyni te ryby bardziej niż inne gatunki wrażliwymi na ruchy wody (Jude i in. 1995). Łuska pokrywająca ciało jest cykloidalna na bokach, grzbiecie, brzuchu i w 1/4 pokryw skrzelowych; w linii środkowej ma zwykle 49-55 (minimum 45, maksimum 57) łusek, oraz 32-33 (min. 31, maks. 34) kręgów.
Dymorfizm płciowy (prócz barw godowych samców) przejawia się w różnym kształcie moczowo-płciowego wyrostka, który jest ulokowany pomiędzy odbytem a podstawą płetwy odbytowej. Żeński jest szeroki i tępy (walcowaty), natomiast męski, będąc dłuższym i ostro zakończonym, ma kształt stożka (Miller 1984, Sapota 2005). N. melanostomus nie ma pęcherza pławnego. | | | | | | Biologia, ekologia | | Samice przystępują do tarła zwykle w wieku 2 lat, chociaż spotyka się je dojrzałe także w pierwszym roku życia (Sapota 2005). Natomiast samce są zdolne do rozrodu przeważnie w wieku 3 lat (Berg 1949, Nikolski 1970, Miller 1986). Tarło odbywa się w strefie przybrzeżnej, na różnych głębokościach - od 0,2 do 3,0 m - czasem parę metrów głębiej. Ryby na miejsce tarła wybierają dno zasobne w kamienie lub inne twarde przedmioty, mogące stanowić strop gniazda, do którego samice przyklejają ikrę. Często przy braku naturalnego substratu ryby wykorzystują sztuczny: kawałki betonu, deski, opony, plastikowe opakowania itp. Poszukiwanie miejsc do złożenia ikry i budowa gniazd zaczyna się, gdy temperatura wody osiąga 10-12°C (Smirnov 1986, za Kalininą 1976).
Tarło N. melanostomus może rozpocząć się już w temperaturze wody 9°C, chociaż za optymalną uważa się temperaturę 15-16°C. W Morzu Kaspijskim obserwowano rozród tego gatunku nawet w temperaturze 26°C (Kovtun 1979). W Morzu Bałtyckim, podobnie jak i w rejonie ponto-kaspijskim, rozród zaczyna się w kwietniu i trwa do września. Składanie ikry może odbywać się porcjami z czterotygodniowymi przerwami. Według Sapoty (2005) w Zatoce Gdańskiej gatunek ten ma dwa okresy nasilenia rozrodu: pierwszy trwa pomiędzy kwietniem a majem, a drugi od lipca do września.
Jedna samica może składać różne porcje jaj - od kilkudziesięciu do niemal dziesięciu tysięcy. Według Wandzla (2000b) w Zatoce Gdańskiej zakres liczby jaj w gonadach wynosił od 89 do 3841. Badając in situ liczbę ziaren ikry, jaką N. melanostomus z różnych miejsc Zatoki Gdańskiej składa w pojedynczych gniazdach, odnotowywano, że do stropu gniazda przyklejanych było od ok. 500 do 1000 jaj. Znajdowano jednak i takie agregacje, które przekraczały 3000 sztuk na jedno gniazdo. Inkubacja ikry w warunkach eksperymentalnych, w zasoleniu 7 PSU trwała zwykle 10-14 dni, przy czym efektywność wylęgów przekracza 90% liczby złożonych jaj (Kozik P. 1999, Skóra K.E. - dane niepubl.)
Samce pilnują gniazd, wentylują ich przestrzeń, bronią ikry i larw przed drapieżnikami. Bronią też terytorium wokół gniazda. Najczęściej odstraszają intruzów wypluwając piasek lub muł znajdujący się u wejścia do nory. Czasem intruza gryzą lub uderzają w niego głową. Straszą, rozpościerając płetwy i rozdymając pokrywy skrzelowe. Samce mogą też wydawać dźwięki: są to sygnały odstraszające przeciwników oraz adorujące samice. Samice po złożeniu wszystkich porcji ikry oddalają się od gniazd w głębsze rejony morza. Opieka samca nad ikrą trwa aż do wyklucia wszystkich larw. Samce opuszczają gniazda dopiero po wykluciu się wszystkich młodych, które od razu przechodzą do demersalnego trybu życia, co wśród bałtyckiej ichtiofauny należy do rzadkości.
Pokarmem N. melanostomus są głównie denne zwierzęta bezkręgowe. U dorosłych przeważają mięczaki, najczęściej są nimi lokalne małże o niezbyt twardych skorupach. Dietę określa skład gatunkowy miejscowej drobnej fauny. W siedliskach roślinnych więcej zjadanych jest fitofilnych skorupiaków i wieloszczetów niż małży, w tym kiełże Gammaridae, podwoiki Idotea balthica, pąkle Balanus improvisus oraz skąpo- i wieloszczety. W wielu płytkich miejscach ważnym komponentem pokarmowym bywa sercówka Cardium glaucum (Rolińska-Jaros 2004; Skóra K. E. - dane niepubl.), choć generalnie w Zatoce Gdańskiej głównymi składnikami pokarmu babki byczej są inne małże - omułek Mytilus trossulus i rogowiec bałtycki Macoma balthica, który na głębokościach 20-30 metrów stanowi ok. 80% składu pokarmu tej ryby. Czasami w żołądkach babki można napotkać ikrę innych gatunków (Skóra i Rzeźnik 2001, Wandzel 2003).
N. melanostomus z mórz basenu ponto-kaspijskiego żyje do czterech lat (Berg 1949, Nikolski 1970), podobny wiek osiągają osobniki z Zatoki Gdańskiej (Sapota 2005). W Zatoce Puckiej dożywają pięciu lat (Skóra i Stolarski 1993b, Wandzel 2003). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Według Aladina i in. (2001) N. melanostomus po raz pierwszy wydostał się poza naturalny zasięg zoogeograficznego występowania w połowie lat 50. XX wieku, kiedy to przypadkowo wsiedlono go do Jeziora Aralskiego, gdzie najprawdopodobniej w latach 80. wyginął na skutek silnego wzrostu zasolenia wód (Petr i in. 2004). Niewykluczone jednak, że gatunek przetrwał w wyższych odcinkach rzek uchodzących do tego zbiornika.
Początek rozprzestrzeniania się N. melanostomus w Europie zauważono w latach 80., gdy nieoczekiwanie odnotowano jego obecność w rzece Moskwa (Sokolov i in. 1989). Był to, jak się przypuszcza, przejściowy etap przenoszenia tego gatunku ku Bałtykowi. Skóra i Stolarski (1993a) wysunęli hipotezę, że do Zatoki Gdańskiej dotarł on z wodami balastowymi statków kursujących pomiędzy Morzem Czarnym, Kaspijskim a Bałtykiem w latach 70.-80. XX wieku. W Polsce ryby tego gatunku zaczęto zauważać dopiero wówczas, gdy swymi rozmiarami przerosły podobne do nich rodzime babkowate, jak: babka czarna Gobius niger Linnaeus1758, babka piaskowa Pomatoschisthus microps i babka mała Pomatoschisthus minutus. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Zawleczenie gatunku do Polski nastąpiło zapewne bezwiednie, lecz nieprzypadkowo, gdyż coraz więcej okoliczności temu sprzyjało, m.in. intensywność i szybkość żeglugi, czy też stałość tras żeglugowych. Nietrudno sobie wyobrazić transport ikry przyklejonej do elementu kadłuba statku czy barki rzecznej. Nie musiała być ona nawet złożona w rejonie Morza Czarnego czy Kaspijskiego, ale znacznie bliżej Bałtyku - w portach na rzece Moskwie. Przy znanej wytrzymałości N. melanostomus na deficyty tlenowe mogło też nastąpić przetransportowanie jego młodych form w wodzie balastowej. Opróżnione zawartości tych zbiorników dla załadunku towarów lub z powodu konieczności wejścia jednostki na stoczniowy dok w miejscu docelowym rejsu (prawdopodobnie w Gdyni) mogły przyczynić się do skutecznego "zarybienia" tym nowym, obcym gatunkiem.
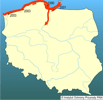
Pierwszy bałtycki okaz N. melanostomus złowiono żakami 9 czerwca 1990 roku w rejonie portu Hel. Na podstawie wieku tej ryby i rozmieszczenia raportów o miejscu złowienia kolejnych osobników ustalono, iż dotarcie tego gatunku do Zatoki Gdańskiej musiało nastąpić przynajmniej 3-4 lata wcześniej w rejonie Gdyni (Skóra i Stolarski 1993b). W 1994 roku obecność tych ryb odnotowywano już niemal w całej polskiej części Zatoki Gdańskiej, a rok później pozyskano pierwsze okazy spoza tego akwenu (Grygiel 1995, Kuczyński 1995, Sapota i Skóra 2005). Pod koniec lat 90. XX wieku babka bycza dotarła (zapewne przez przyujściowe odcinki rzek) do przymorskich jezior Łebsko i Gardno (Ciepielowski i Hornatkiewicz-Żbik 2003).
Obserwując stały wzrost liczebny populacji N. melanostomus w Zatoce Gdańskiej zauważono (Sapota 2002), że gatunek ten zaczął wnikać w estuarium Wisły. W końcu lat 90. występował już zarówno w Motławie, jak i Wiśle Śmiałej w rejonie Przegaliny (Kozik 1999, Skóra K. E. - dane niepubl.). W roku 1999 stwierdzono pierwsze okazy babki byczej w polskiej części Zalewu Wiślanego (Borowski 1999), a dwa lata później w jego części rosyjskiej (Tylik K. - inf. ustna; Zakrevskij 2004). Jak wynika z najnowszych doniesień, ekspansja N. melanostomus postępuje w górę Wisły oraz jej dopływów (np. Wierzycy). Najwyżej położone stanowisko zostało znalezione 130 km od ujścia na wysokości Świecia (Kostrzewa i Grabowski 2003). Tu zasięg zoogeograficznego występowania N. melanostomus zaczyna się nakładać z podążającym od południowego wschodu Europy innym ponto-kaspijskim gatunkiem - Neogobius fluviatilis, który dotarł już do Wisły do odcinka Gniewo-Tczew (kol. 09.07.2003. - Skóra K.E. - dane niepubl.).
Przez pewien czas całkowicie brakowało potwierdzeń występowania babki byczej na środkowym i zachodnim wybrzeżu Polski, a jedyna informacja, jaka pochodziła z rejonu Zatoki Pomorskiej z 1996 roku, nie była dobrze udokumentowana (Stepanowska K. - inf. ustna). Obserwacje podwodne, dokonane w 2003 r., oraz wywiady z wędkarzami pozwoliły wykazać obecność N. melanostomus w rejonie umocnień brzegowych koło Jarosławca oraz w Dziwnowie w kanale ujściowym rzeki. Otrzymano także pierwsze informacje o połowach tego gatunku przez wędkarzy w Kanale Piastowskim w Świnoujściu (Wolnomiejski N. - inf. ustna; Stepanowska K. - inf. ustna; Skóra K.E.; Woźniewska - dane niepubl.).
Potwierdzono, spodziewaną na podstawie doniesień Ciepielewskiego i Hornatkiewicz-Żbik (2003), obecność babki byczej w Łebie - w basenach portu i ujściowym odcinku rzeki, łączącym morze z jeziorem Łebsko. Stwierdzono także, że miejscem bardzo licznego zasiedlenia jest obecnie rejon podwodnych umocnień portu Władysławowo. | | | | | | Występowanie na terenach chronionych | | Z dotychczasowych informacji wynika, że w Polsce gatunek ten występuje w wodach Nadmorskiego Parku Krajobrazowego - w morskiej strefie, oraz w rzekach i przymorskich jeziorach (Gardno, Łebsko) Słowińskiego Parku Narodowego. Występuje też w wodach morskich i estuarium Odry w obrębie Wolińskiego Parku Narodowego. Wymienione akweny wytypowano do sytemu ochrony Natura 2000. Gatunek ten jest też obecny w morskich i zalewowych wodach przyległych do Parku Krajobrazowego Mierzei Wiślanej. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Obecność N. melanostomus w Bałtyku otwiera nowy etap w ewolucji przybrzeżnych biocenoz tego morza. Należy przypuszczać, iż skład demersalnej ichtiofauny płytkiego sublitoralu ulegał będzie stopniowemu przeobrażaniu. Konsekwencje tych zmian będą się przejawiać po- przez powiązania troficzne i z pewnością zaznaczą się także poza ekosystemem morza.
Obserwacje z rejonu Zatoki Puckiej wskazują, że N. melanostomus wypiera rodzime gatunki - głównie z rodziny Gobiidae - zajmując ich tradycyjne miejsca schronienia: kryjówki pod kamieniami i muszlami, szczeliny w konstrukcjach hydrotechnicznych i wraki. Efektem jest wzrost śmiertelności krajowych Gobiidae przez większe wyeksponowanie ich na atak drapieżników (ryb, ptaków).
Drugi problem ekologiczny to potencjalna konkurencja troficzna, jeśli tylko zasoby pokarmowe wspólne dla współbytujących gatunków będą limitowane. Stwierdzono znaczną zbieżność diety N. melanostomus z pokarmem pobieranym przez niektóre rodzime gatunki ryb (Skóra i Rzeźnik 2000, Karlson i in. 2005).
Trzecim, ważnym ekologicznie skutkiem obecności babki byczej w ekosystemie Zatoki Gdańskiej jest fakt, że gatunek ten stał się masowym konsumentem małży, głównie omułka Mytilus edulis . Taka ekologiczna rola nie była przypisana żadnemu z rodzimych gatunków. Babka bycza, występując licznie i będąc łatwo dostępnym pokarmem dla ichtiofagów, uruchomiła transfer zakumulowanych zanieczyszczeń w tkankach małży, kierując je w górę piramidy troficznej, nie wyłączając człowieka, jako konsumenta ryb.
Należy też zauważyć, że masowe występowanie N. melanostomus przede wszystkim wzbogaciło bazę pokarmową żerujących w morzu kormoranów i czapli. Liczebność kolonii obu tych gatunków nad Zatoką Gdańską wyraźnie wzrosła (Bzoma 1998, Jakubas 2004, 2005; Jakubas i Mioduszewska 2005). Na razie nie wiadomo, czy nowy gatunek - będąc główną pozycją w diecie lokalnych kolonii kormoranów - nie przyczynia się do poprawy sytuacji tradycyjnych ofiar tych ptaków, czyli ryb pelagicznych. Można się też spodziewać dalszych skutków oddziaływania babki byczej na strukturę i funkcjonowanie morskiego ekosystemu, np. może ona spowodować wzrost ilości zooplantktofagów w wodach Bałtyku (np. ryb dobijakowatych Ammodytidae). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Zmiana stosunków międzygatunkowych i biocenotycznych w wodach przybrzeżnych Bałtyku, estuariów, jezior i rzek, spowodowana przez babkę byczą, stanowi ważny problem ekologiczny, a nawet i ekonomiczny, jak też stwarza pewne zagrożenie dla rodzimych gatunków, które podlegają wypieraniu i limitowaniu przez nowy, inwazyjny gatunek. Ekonomicznie szkodliwą stroną obecności babki byczej w Zatoce Gdańskiej jest jej coraz liczniejsze występowanie w połowach rybackich, co przy braku konsumenckiego popytu na ten gatunek powoduje dodatkowe nakłady czasu przy oporządzaniu sprzętu połowowego. W okresie wiosny, gdy żaki i denne sieci stawne łowiących na Zatoce Puckiej rybaków są wypełniane babką byczą, obniża się potencjał połowowy innych ryb. Rybacy obwiniają ten gatunek także za usuwanie przynęt z dennych zestawów haczykowych, które wystawiają w celu połowu węgorzy.
Wytępić tego gatunku w wodach Bałtyku już się nie da. Przed wnikaniem następnych obcych gatunków ryb może chronić lepsza kontrola i utylizacja wód balastowych statków. Należy się jednak spodziewać rychłego odnotowania w strefie ujściowej Wisły, a później i w morzu, dwóch innych ponto-kaspijskich gatunków Gobiidae - babki łysej Neogobius gymnotrachelus i babki szczupłej Neogobius fluviatilis, które rozszerzają swój geograficzny zasięg występowania, podążając ku Bałtykowi systemem rzecznym (Skóra 2004). Trudno wyrokować, jakie zostaną ustalone relacje ekologiczne pomiędzy tymi gatunkami w nowym miejscu ich występowania. Babka bycza nie jest i nie powinna być na terytorium Polski objęta jakąkolwiek ochroną. Chcąc ograniczyć jej rozprzestrzenianie i liczebność należy wprowadzić zakaz wypuszczania złowionych ryb oraz zakaz przenoszenia ich do innych zbiorników i cieków wodnych.
Za biologiczne, potencjalnie pomocne środki w zmniejszeniu liczebności N. melanostomus w Zatoce Puckiej należy uznać wzmocnienie przez zarybianie lokalnych zasobów węgorza Anguilla anguilla i sandacza Stizostedion lucioperca. Pierwszy z nich penetruje kryjówki N. melanostomus i odganiając z nich samce, wyjada inkubowaną na stropie gniazd ikrę. Drugi natomiast, z uwagi na zbieżną z potencjalną ofiarą, nocną porę aktywności ma większą niż inne drapieżniki szansę na redukcję liczebności tego obcego gatunku.
Ważnym czynnikiem ograniczającym wielkość populacji N. melanostomus w naszych wodach byłoby też intensywne pozyskiwanie tego gatunku w ramach przybrzeżnego rybołówstwa. Nie dokona się tego przy braku rynkowego popytu na ten gatunek i wyrobienia w polskim społeczeństwie trwałego zwyczaju konsumpcji babki byczej (Skóra 1999). | | | | | | Prognoza | | Można przypuszczać, że sukces w globalnej ekspansji N. melanostomus - gatunku, który dotarł aż do Wielkich Jezior Ameryki Północnej (Jude i in. 1991), jest w dużej mierze spowodowany takimi czynnikami antropogenicznymi, jak rozwój żeglugi oraz hydrotechniczne przekształcenia rzek i wybrzeży.
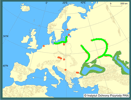
W Polsce babka bycza jest już szeroko rozprzestrzeniona. W Zatoce Gdańskiej populacja tego gatunku jest jedną z wiodących w strefie przybrzeżnej. Od tego miejsca rozpoczęła się jego ekspansja na sąsiednie akweny Bałtyku. Regularnie odnotowywany jest w połowach na Zalewie Wiślanym. Opanowuje przyujściowe odcinki pomorskich rzek oraz dopływy dolnego odcinka Wisły. Wzdłuż niemal całego polskiego wybrzeża z sukcesem zasiedla wszelkie podwodne części hydrotechnicznych budowli morskich: portowe pirsy, kamieniste umocnienia brzegu, mola, dalby itp. Spotykany jest także dalej od brzegów w obrębie płytko zatopionych wraków jednostek pływających. Gatunek wyraźnie rozprzestrzenia się w kierunku zachodnim i na północny wschód od Zatoki Gdańskiej.
Pierwszym, poza Polską europejskim krajem, do którego dotarł nowy gatunek były Niemcy. W 1999 roku pojedyncze okazy u wybrzeży Rugii stwierdził H. Winkler (dane niepubl.). Nowe obserwacje babki byczej pochodzą z rejonu przylądka Darss na wyspie Zingst (Skóra 2003). Jest to na razie najdalszy, zachodni kraniec zakresu występowania tego gatunku w Bałtyku. Na wschodnim wybrzeżu tego morza został on odnotowany w 2002 roku, gdy pojedyncze okazy złowiono najpierw w estońskiej Zatoce Parnu (Ojaver 2002), a kilka miesięcy później w rejonie portu Kłajpeda (Smiltyne) na Litwie (Bacevicius 2003a, 2003b; Zolubas 2003). W kwietniu 2004 roku złowiono pierwszy, a w lecie parę kolejnych okazów babki byczej u wybrzeży Łotwy (Lepaja) (Ojaver H. - inf. ustna za Atus Minde). W lutym 2005r., o pierwszym złowionym okazie tego gatunku zameldowano z okolic Turku w Finlandii (Leppäkoski - inf. ustna; Lumiaro i Andersin 2005). Jak dotąd brak jest danych o występowaniu tej babki u szwedzkich i duńskich brzegów Bałtyku. Można się jednak spodziewać, że dotrze tam wkrótce, co doprowadzi do dalszej eskalacji jej inwazyjnych pojawów.
Jest tylko kwestią czasu, aby N. melanostomus opanował nową, śródlądową drogę samoistnego rozprzestrzeniania się ku Bałtykowi. Uczyniły to już Neogobius fluviatilis (Pallas, 1811) oraz N. gymnotrachelus (Kessler, 1857), które przez Dniepr, Prypeć i Kanał Królewski przeniknęły do dorzecza Wisły (Danilkiewicz 1996, 1998). Że podąża tą drogą także N. melanostomus świadczy fakt stosunkowo niedawnego odnotowania go w rejonie Żlobina na Białorusi (Guljugin 1998).
Warto dodać, że N. melanostomus wykazuje także ekspansję w górę rzek zlewiska Morza Czarnego. Jak podaje Simonovic i in. (1998) w latach 1997 i 1998 dwie pierwsze ryby tego gatunku odkryto w granicach Jugosławii, 861 km od ujścia Dunaju koło Prahova. Dwa lata później stwierdzono go już w rejonie Wiednia (Wiesner i in. 2000), a w 2001 w pobliżu Wolfsthal i Krems (Wiesner 2003). W 2003 roku pojawił się w słowackiej części tej rzeki (Stráňai i Andreji 2004).
Można przypuszczać, że przy braku odpowiedniej kontroli i utylizacji wód balastowych statków N. melanostomus dokona ekspansji globalnej. Sprzyjają temu jego naturalne, biologiczne i ekologiczne predyspozycje - euryhalinowość, oportunistyczne korzystanie z bazy pokarmowej, porcyjny i rozciągnięty w czasie rozród, sprawowanie opieki nad złożoną ikrą. Praktycznie, każde estuarium rzek uchodzących do morza w strefie klimatu umiarkowanego (obu Ameryk, Azji, Australii czy Nowej Zelandii) jest dziś potencjalnym miejscem wsiedlenia i zawleczenia tego gatunku.
Babka bycza stała się prawdopodobnie trwałym elementem bałtyckiej ichtiofauny. Rola, jaką w przyszłości odegra ona w strefie przybrzeżnej tego morza, będzie zapewne wypadkową jej biologicznych predyspozycji oraz skali antropogenicznych przekształceń środowiska Bałtyku. | | | | | | Literatura | | - Aladin N.V., Plotnikov I.S., Filippov A.A. 2001. Opportunistic Settlers in the Aral Sea. Caspian Environment Programme. The First International Workshop to discuss the problems of the invasion of the Caspian Sea by the comb jelly Mnemiopsis leidyi. Baku, Azerbaijan, 24-26 April 2001. [http:/www.caspianenvironment.org/mnemiopsis/mnem_attach9.htm]
- Bacevicius E. 2003a. Baltijos juros najakurys - grundalas rubuilis. Klaipeda, Jura 37 (431): 5-7.
- Bacevicius E. 2003b. Baltijos juros ir Kursiu mariu najakurys - grundalas rubilis. Zukle 10 (1): 56-59.
- Berg L.S. 1949. Freshwater fishes of the USSR and adjacent countries. Acad. Sci. USSR Zool. Inst.: 1083-1086.
- Bogachik T.A. 1967. Morfologicheskaja adaptativnost golotochnovo apparata bychkov Charnovo Morya. Voprosy Ikhtiologii 7: 108-116.
- Borowski W. 1999. Babka bycza w Zalewie Wiślanym. Magazyn Przemysłu Rybnego 4 (12): 39.
- Bzoma S. 1998.The contribution of round goby (Neogobius melanostomus Pallas, 1811) to the food supply of cormorants (Phalacrocorax carbo Linnaeus 1758) feeding in the Puck bay (Poland). Bulletin of the sea Fisheries Institute, Gdynia 144: 39-47.
- Ciepielewski W., Hornatkiewicz-Żbik A. 2003. Różnorodność ichtiofauny w jeziorach Słowińskiego Parku Narodowego. Komunikaty Rybackie Instytutu Rybactwa Śródlądowego, Olsztyn 2: 22-26.
- Danilkiewicz Z. 1996. Babka łysa (gołogłowa), Neogobius gymnotrachelus (Kessler, 1857) (Perciformes, Gobiidae) - nowy gatunek w ichtiofaunie zlewiska Morza Baltyckiego. Komunikaty Rybackie Instytutu Rybactwa Śródlądowego 2: 27-29.
- Danilkiewicz Z. 1998. Babka szczupła, Neogobius fluviatilis (Pallas, 1811), Perciformes, Gobiidae - nowy, pontyjski element w ichtiofaunie zlewiska Morza Bałtyckiego. Fragmenta Faunistica 41: 269-277.
- Grygiel W. 1995. Występowanie nowego gatunku babki Neogobius melanostomus (Pallas 1811) w polskich obszarach morskich. Notatka w Zakładzie Biologii i Ochrony Zasobów Morskiego Instytutu Rybackiego, Gdynia: 1.
- Guljugin S.Y. 1998. Rosprostranienije areala ponyokaspijskih buchkov Neogobius fluviatilis, N. melanostomus pod vozdiejstvem antropogennyh faktorov.
- Jakubas D. 2004. The response of grey heron to rapid increase of the round goby. Waterbirds 27: 304-307.
- Jakubas D. 2005. Factors affecting the breeding success of the grey heron (Ardea cinerea) in northern Poland. Joural of Ornithology 146: 27-33.
- Jakubas D., Mioduszewska A. 2005. Diet composition and food consumption of the grey heron (Ardea cinerea) from breeding colonies in northern Poland. European Journal of Wildlife Research, Volume 51, Issue 3, Sep. 2005: 191-198
- Jude D.J., Reider, R.H., Smith, G.R. 1991. First evidence of Gobiidae in the Great Lakes basin. In: Great Lakes Research, Buffalo, N.Y. (USA), Programme and Abstracts, published by: IAGLR/Univ. Michigan, Ann Arbor, Mi. USA: 124.
- Jude D.J., Janssen J., Crawford G. 1995. Ecology and distribution of the newly introduced tubenose and round gobies in the St. Clair and Detroit Rivers. In: Munawar M., Edsall T., Leach J. (eds) The Lake Huron Ecosystem: Ecology, Fisheries, and Management. Academic Publishing, Amsterdam: 447-460.
- Karlson A.M.L., Almqvist G., Skóra K.E., Apepelberg M. 2005. Diet overlap and preferences of non-indigenous round goby and native flounder in the Baltic Sea indicate competition. Manuscript. Department of Systems Ecology, Stockholm University SE- 106 91 Stockholm, Sweden: 1-27.
- Kostrzewa J., Grabowski M. 2003. Oportunistic feeding strategy as factor promoting the expansion of racer goby (Neogobius gymnotrachelus Kessler, 1857) in the Vistula basin. Lauterbornia 48: 91-100.
- Kovtun I.F. 1979. Significance of the sex ratio in the spawning population of the round goby in relation to year-class strength in the Sea of Azov. Journal of Ichthyology 9: 161-163.
- Kozik P. 1999. Rozród babki byczej w Zatoce Gdańskiej. Praca magisterska. Stacja Morska Instytutu Oceanografii Uniwersytetu Gdańskiego, Hel: 1-132.
- Kuczyński J. 1995. Babka krągła N. melanostomus (Pallas, 1811) - emigrant z Basenu Pontokaspijskiego w Zatoce Gdańskiej, Bulletin of the Sea Fisheries Institute 2 (135): 68-71.
- Lumiaro R., Andersin A.-B. 2005. En ny fiskart har paträffats i Skärgardshavet. Östersjöportal. http://iceservice.fi/sv/itamerikanta/uutiset/684.html.
- Miller P.J. 1984. Tokology of gobies. In: Potts G. W. and Wootton. R. J. (eds.) Fish reproduction. Academic Press. Ltd., London: 119-153.
- Miller P.J. 1986. Gobiidae. In: Whitehead P.J.P., Bauchot M.L., Hureau J.C., Nielsen J., Tortonese E. (eds) Fishes of the northeast Atlantic and Mediterranean. UNESCO, Paris: 1019-1095.
- Nikolski G. V. 1970. Ichtiologia szczegółowa. Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa: 1-546.
- Ojaver H. 2002. http://www.sea.ee/Sektorid/merebioloogia/MASE/Fish.htm], 2004.01.19 on line.
- Petr T., Ismukhanov K., Kamilov B., Pulatkhon D., Umarov P. D. 2004. Irrigation Systems and their Fisheries in the Aral Sea Basin, Central Asia. In: Food and Agriculture Organization of the United Nations (FAO), Regional Office for Asia and the Pacific; Mekong River Commission (MRC), Fisheries Programme (FP): 1-21.
- Pinchuk V.I. 1991. Species groupings in the genus Neogobius (Perciformes) . Journal of Ichthyology 31: 1-15.
- Rolińska-Jaros M. 2004. Pokarm Neogobius melanostomus (Pallas 1811) w strefie przybrzeżnej Zatoki Puckiej. Praca magisterska. Stacja Morska Instytutu Oceanografii Uniwersytetu Gdańskiego, Hel: 1-56.
- Sapota M.R. 2002. Invasion of round goby (Neogobius melanostomus) from the Ponto-Caspian to the Baltic. BIOMARE Newsletter 2: 7.
- Sapota M.R. 2005. Biologia i ekologia babki byczej Neogobius melanostomus (Pallas 1811) gatunku inwazyjnego w Zatoce Gańskiej. Wydawnictwo Uniwersytetu Gdańskiego, Gdańsk: 1-120.
- Sapota M.R., Skóra K.E. 2005. Spreading of alien (non-indigenous) fish species Neogobius melanostomus in the Gulf of Gdańsk (South Baltic). Biological Invasions 7: 157-164.
- Simonovic P., Valkovic B., Paunovic M. 1998. Round goby Neogobius melanostomus, a new Ponto-Caspian element for Yugoslavia. Folia Zoologica Brno 47: 305-312.
- Skóra K.E. 1999. Byczki - falsyfikaty w puszkach. Magazyn Przemysłu Rybnego, Gdynia 2 (10): 27-28.
- Skóra K.E. 2003. http://www.hel.univ.gda.pl/aktu/ROK03/babka.htm,
- 2004.03.01, on line.
- Skóra K.E. 2004. Current Zoogeographical Range of the Expansion of Neogobius melanostomus in Poland and in Other Regions in Europe. In: Report of the Working Group on Introductions and Transfers of Marine Organisms ICES CM 2004/ACME:05 Ref. E, G, Appendix 1: 78-81.
- Skóra K.E. 2005. Problem polskiego nazewnictwa dla Neogobius melanostomus (Pallas 1814). Hel, Rocznik Helski, T. III: 31-37.
- Skóra K.E., Rzeźnik J. 2001. Observations on diet composition of Neogobius melanostomus Pallas 1811 (Gobiidae, Pisces) in the Gulf of Gdansk (Baltic Sea). Journal of Great Lakes Research 27 (3): 290-299.
- Skóra K.E., Stolarski J. 1993a. New fish species in the Gulf of Gdańsk. Neogobius sp. [cf. Neogobius melanostomus (Pallas 1811)], Bulletin of the Sea Fisheries Institute, Gdynia 1 (128): 83.
- Skóra K.E., Stolarski J. 1993b. Neogobius melanostomus (Pallas 1811) a new immigrant species in the Baltic Sea. Estuarine ecosystems and species. Proceedings of 2nd International Estuary Symposium held in Gdańsk, October 18-22, 1993. PAS, Gdynia, Crangon, 1: 101-108.
- Smirnov A.N. 1986. Fauna Ukrainy v soroka tomach. Tom 8. Naukova Dumka Kijev: 33-57.
- Sokolov L.I., Sokolova E.L., Goloviatok G.Yu. 1989. New inhabitants of the River Moscow. Priroda 9: 80-81.
- Stepanova T.G., Ragimov D.B., Mitrofanov I.V. 2002. Neogobius melanostomus (Pallas, 1814). In: Belyaeva V.N. (ed). Caspian Sea Biodiversity Database. http://www.caspianenvironment.org/biodb/eng/main.htm
- Stráňai I., Andreji J. 2004. The first report of round goby, Neogobius melanostomus (Pisces, Gobiidae) in the waters of Slovakia. Folia Zoologica 53 (3): 335-338.
- Svetovidov A.N. 1964. Ryby Černogo Morja. Nauka, Moskwa: 337-440.
- Trifonov G.P. 1955. On reproductive biology of gobies from the Azov Sea. Tr. Karadagskoi Biol. Stantsii 13: 5-46.
- Wandzel T. 2000a. Round goby (Neogobius melanostomus Pallas 1811) in the catches of r/v Baltic. Acta Ichthyologica et Pescatoria: 30 (1): 81-91.
- Wandzel T. 2000b. The fecundity and reproduction of round goby Neogobius melanostomus (Pallas 1811) in the Puck Bay (Baltic Sea). Bulletin of the Sea Fisheries Institute, Gdynia 2: 43-51.
- Wandzel T. 2003. Babka okrągła Neogobius melanostomus (Pallas 1811) - nowy komponent ichtiocenozy południowego Bałtyku. MIR, Gdynia: 76.
- Wiesner C. 2003. Eingeschleppte Meeresgrundeln in der Österreichischen Donau - Gefahren und Potenziale. Am Fischwasser 3/4: 29-31.
- Wiesner C., Spolwind R., Waidbacher H., Guttmann S., Doblinger A. 2000. Erstnachweis der Schwarzmundgrundel Neogobius melanostomus (Pallas, 1814) in Österreich. Österreichs Fischerei 53: 330-331.
- Zakrevskij E. 2004. Pokhod bychka za tri morja. Zhurnal Baltijskij rybakov. No 3. http://kaliningrad-fishing.ru/zhurnal/20-2004/statja-011.html
- Zolubas T. 2003. Nauja invazine zuvu rusis Lietuvos priekrantes vadenyse. Jura ir aplinka 9 (2): 52-55.
| | | | | | Streszczenie | | Neogobius melanostomus is a fish species of Ponto-Caspian origin. It was unintentionally introduced at the end of the 20th century into Polish waters where it has become a strongly invasive species. Its first individuals were noted in the Gulf of Gdańsk in 1990 and a few years later it colonized the entire gulf. The accepted hypothesis is that this species invasion occurred via ballast water of ships; however, it is also possible that the fry of Round Goby was brought by boats. At the end of the 1990s Round Goby reached the waters of littoral lakes (Gardno, Łebsko) and in 1999 it was first noted in the Vistula Lagoon. At the beginning of the 21th century the species colonized almost the whole of the Polish Baltic Coast. It enters also the lower stretch of the Vistula River and estuarine stretches of Pomeranian rivers.
The species has multiplied explosively and dominated the ichthyocenoses of the Polish coastal waters of the Baltic Sea, causing significant changes in marine ecosystems, among others the competitive displacement of certain native fish species. On the other hand, Round Goby makes a substantial addition to the diet of piscivorous birds, particularly cormorant and common heron. | | | | | | Opracowanie | | Krzysztof E. Skóra | | | | |
|