
Perccottus glenii Dybowski, 1877
trawianka
Amur Sleeper |   | Rodzina | | Odontobutidae | | Rząd | | Perciformes okoniokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
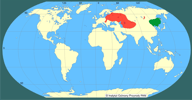
 | | | | | | Uwagi taksonomiczne | | Grupa ryb podobna do babkowców (Gobioidei), od których odróżnia się m.in. niezrośniętymi płetwami brzusznymi (Nikolski, 1970). Rodzaj Perccottus został włączony do rodziny Odontobutidae, bowiem pozostaje w bliskim pokrewieństwie ze słodkowodnymi rodzajami Micropercops i Odontobutis wschodniej Palearktyki (Elovenko 1981; Hoese, Gill 1993; Nelson 1994). | | | | | | Locus typicus/Terra typica | | Ussuri i dopływy (dorzecze Amuru), Daleki Wschód. | | | | | | Pierwotna ojczyzna gatunku | | Rozciąga się ona od południowego wybrzeża Morza Ochockiego do Półwyspu Koreańskiego i Morza Żółtego. Występuje w środkowym i dolnym Amurze wraz z jego dopływami: Ussuri, Zeja, Sungari, Sujfun, w systemie rzeki Tumień-ała i Tugur wpadających do M. Ochockiego, a ponadto w północno-zachodnim Sachalinie, w okolicach Port-Artur, jeziorze Chanka, w Mandżurii i północno-wschodniej Korei (Berg 1949, Rešetnikov 1998, Terlecki 2000, Bogucka i Naseka 2002). | | | | | | Podstawowe cechy morfologiczne | | Ciało wrzecionowate, wydłużone, w przedniej części na przekroju poprzecznym walcowate, w tylnej bocznie ścieśnione. Osiąga maksymalną długość 25 cm. Głowa duża i mocno spłaszczona, od góry w tylnej partii pokryta łuskami. Pysk szeroki, żuchwa wystaje ponad szczękę, co usadawia go w górnym położeniu. Oczy są duże, przesunięte w górne partie głowy. Dwie płetwy grzbietowe oddzielone od siebie, z których tylna jest większa, wielkością i kształtem zbliżona do odbytowej. Płetwa ogonowa duża zaokrąglona. Płetwy brzuszne niewielkich rozmiarów usadowione są tuż pod piersiowymi. Łuski na bokach ciała ktenoidalne, na grzbiecie cykloidalne.
Ubarwienie jest zmienne, od oliwkowozielonego do szarobrunatnego, uwarunkowane charakterem zbiornika i jego dna. Na bokach i brzuchu występują ciemnobrunatne, nieregularne plamy i smugi. Od pyska przez oczy do końca pokrywy skrzelowej biegnie ciemna pręga. Na pierwszej płetwie grzbietowej znajdują się 3-4 ciemno pigmentowane smugi. Podobny wzór znajduje się na płetwie ogonowej i odbytowej. W okresie godowym samce są wyraźnie ciemniejsze od samic, a na ich górnej części głowy pojawia się guz tłuszczowy. Poza tym okresem dymorfizm płciowy objawia się głównie w budowie płetw grzbietowych i brzusznych. U samców płetwy grzbietowe są większe, bardziej zbliżone do siebie i jaskrawiej wybarwione, natomiast brzuszne są wyraźnie krótsze niż u samic (Gluchovec i Durkavec 1987, Pietraszewski i Grabowska 2007). | | | | | | Biologia, ekologia | | Gatunek ten preferuje wody wolno płynące i stojące; głównie silnie zarośnięte płytkie jeziora z dużą ilością osadów dennych, starorzecza, stawy i drobne zbiorniki z tendencjami do wysychania i zamarzania do dna. W większych akwenach zasiedla strefę litoralną. Znosi deficyty tlenowe, dlatego też często towarzyszą mu piskorz Misgurnus fossilis i karaś Carassius carassius. W przyduchowych akwenach bywa jedynym gatunkiem ryby. Aktywność życiową wykazuje w temperaturach od 1-2 do 20, a nawet przy 37°C (Kirpičnikov 1945, Berg 1949, Spanovskaja i in. 1964, Nikolski 1970, Kautman 1999, Bogucka i Naseka 2002).
Dojrzałość płciową osiąga po ukończeniu dwóch lat przy wymiarach 5-6 cm. Tarło w dorzeczu Amuru ma miejsce w maju i czerwcu, gdy woda osiągnie temperaturę 15-20°C. Ikra składana jest w kilku porcjach - od 250 do 600 ziaren. Płodność waha się od 1000 do 2000 jaj. U największych azjatyckich osobników płodność sięga nawet 37 000 jaj. Są one przeźroczyste, lepkie, elipsoidalnie wydłużone. Najczęściej o długości od 1,0 do 1,8 mm. Maksymalne rozmiary jaj mogą osiągać długość 3,8 mm i szerokość 1,3 mm. W Zbiorniku Włocławskim okres reprodukcji trawianki trwa od kwietnia do sierpnia, a płodność waha się od 680 do 23 479 (średnio 7 066) jaj. Indeks gonadosomatyczny (GSI) dla samic w tym czasie wynosi 3,69-8,28, a samców 0,52-1,1.
Przed tarłem para odbywa taniec godowy. Ikra składana jest najczęściej na roślinach, kamieniach i innych trwałych na dnie przedmiotach (lito-fitofilna grupa rozrodcza). Rozwój embrionalny przy temperaturze wody 19oC trwa 10-12 dni. Do momentu wyklucia larw opiekę sprawuje samiec. Długość świeżo wylęgłych larw waha się od 4,5-5,0 mm. Trzydniowe larwy pływają już swobodnie w toni wodnej i rozpoczynają poszukiwanie pokarmu.
Pokarm młodocianych stadiów tego gatunku stanowią głównie larwy owadów wodnych (Chironomidae, Ephemeroptera, Odonata, Trichoptera, Coleoptera, Heteroptera), skorupiaki (Copepoda, Cladocera) oraz narybek współbytujących gatunków. Trawianka preferuje larwy komarów (Culicidae), przyczyniając się w dużym stopniu do redukcji ich liczebności w akwenach. Roczny narybek potrafi w ciągu dnia zjeść do 15, a starsze osobniki do 80 larw komarów. W miarę wzrostu, a szczególnie powiększania się pyska, trawianki zjadają coraz większe ofiary. Potrafią połykać ryby mierzące nawet 2/3 swojej długości, przez to stanowią poważne zagrożenie dla wielu cennych gospodarczo gatunków (Kirpičnikov 1945, Berg 1949, Spanovskaja i in. 1964, Nikolski 1970, Litvinov i O'Gorman 1996, Travkina 1997, Kautman 1999, 2000; Kostrzewa i in. 2000, Bogucka i Naseka 2002, Pietraszewski i in. 2007, Sikorska i in. 2007). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Pierwsze informacje o introdukcji tego gatunku na teren Europy pochodzą z 1912 r., a pierwsze okazy przywiezione zostały z rzeki Zeja, dorzecza Amuru (Boznak 2004). Hodowane w akwariach ryby w 1916 roku zostały wypuszczone do stawów parkowych w miejscowości Lisij Nos (okolice St. Petersburga). Z tego terenu trawianka rozprzestrzeniła się do okolicznych jezior i Zatoki Fińskiej (Kuderskij 1980). W 1948 r. gatunek ten został przywieziony przez uczestników Amurskiej Ekspedycji do Moskwy, gdzie był hodowany w akwariach, a w następnych latach został wypuszczony do wód otwartych (Spanovskaja i in. 1964, Dmitrijev 1971, Boznak 2004). W 1970 r. został wprowadzony do gospodarstw rybackich w okolice Nižnego Novgorodu wraz z amurskim karpiem Cyprinus carpio haematopterus (Kuderskij 1980). Z tych to miejsc, via rzeki Moskwa i Oka, zasiedlił środkowe dorzecze Wołgi (Gluchovec i Durkavec 1987). W tym samym roku pojawił się w rejonie Gorki, w 1981 r. był stwierdzony w zbiorniku Kujbyszewskim, w 1983 r. w zb. Saratowskim, w 1996 r. w zb. Wołgogradzkim. O licznym występowaniu tego gatunku w tych regionach Rosji świadczą lokalne połowy rybackie wynoszące w latach 1988-1989 od 0,9 do 1,6 tony (Bogucka i Naseka 2002). Prawdopodobnie w 1994 r. gatunek ten pojawił się w północnej części Rosji, w Północnej Dźwinie.
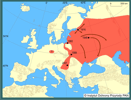
W 1982 r. trawiankę stwierdzono w rejonie Kaliningradu w jez. Inzgener (Diripasko 1996). Jezioro to łączy się z Pregołą, która uchodzi do Zalewu Wiślanego. W ostatnich kilkunastu latach na terenie Europy Środkowej i Wschodniej odnotowano bardzo szybkie rozprzestrzenianie się tego gatunku. Stwierdzono go wkrótce w dorzeczu Dźwiny (Łotwa - Plikšs i Aleksejevs 1998), Donu, Dniepru i Dniestru (Ukraina - Kozlov 1993, Bogucka i Naseka 2002), Cisy (Węgry od 1997 r. - Harka 1998, Harka i Sallai 1999, Moshu i Guzun 2002) oraz jej wschodniosłowackich dopływach - Latorica, Bodrog (od 1998 r. - Kautman 1999, Koščo i in. 1999, 2003; Koščo i Košuth 2002, Lusk i in. 2004), gdzie szybko utworzył bardzo liczebne populacje. W 2001 r. trawianka pojawiła się po raz pierwszy w Serbii (Vojvodina), a prawdopodobnie rozprzestrzeniła się z Węgier systemem rzecznym Cisy (Gergely i Tucakov 2003).
Według oceny Kozlova (1993) gatunek ten z obszaru Moskwy do Wołgi rozprzestrzeniał się z prędkością ok. 12 km/rok, a w samej Wołdze 5 razy szybciej (ok. 67 km/rok). Przypuszcza się, że w kierunku północno-zachodnim (basen Bałtyku) szybkość rozprzestrzeniania się trawianki może sięgać 10-12 km/rok.
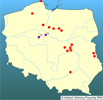
Poza Europą gatunek ten bardzo szeroko rozprzestrzenił się na znacznym obszarze niektórych republik byłego ZSSR, wprowadzony był do akwenów Azji Środkowej (Kazachstan, Uzbekistan, Turkmenistan), a nawet do Bajkału i jego dopływów (Rešetnikov 1998, Sideleva 2001, Bogucka i Naseka 2002). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Na terenie Polski Perccottus glenii po raz pierwszy został odnotowany w 1993 r. w starorzeczu Wisły k. Dęblina (Antychowicz 1994), choć do dorzecza Wisły dotarł wcześniej, bowiem w 1988 r. został stwierdzony w rzece Wisznia (dopływ Sanu) na terenie Ukrainy (Movčan 1989). W 1996 r. stwierdzono jego obecność w Wiśle i jej starorzeczach na odcinku od Solca aż po ujście Wieprza (Terlecki i Pałka 1999); w 1997 r. w okolicach Otwocka, Łomianek, Wyszogrodu, w Warszawie i okolicach Płocka (Woźniewski 1997, Kostrzewa i in. 1999); w 1998 r. w Zbiorniku Włocławskim (Kakareko 1999), a ostatnio już w przyujściowym odcinku koło Tczewa (Wiśniewolski i in. 2001). Od momentu wykrycia gatunek ten w ciągu 6-7 lat zdołał zasiedlić środkowy i dolny odcinek Wisły o długości prawie 600 km (Witkowski 2002). Tempo jego ekspansji w Wiśle można ocenić na ok. 80-100 km/rok. W ostatnich dwóch latach odnotowany był na odcinku Bugu między Hrubieszowem a Zabużem, w Pacynce (dopływ Radomki) oraz w Zwolence (dopływ Wisły) k. Kozienic (Błachuta i in. 2002, Kotusz J. - inf. ustna). W 2000 r. odnotowany został w stawach w okolicach Ozorkowa k. Łodzi, gdzie trafił z rybami sprowadzonymi z Białorusi (Witkowski i Kotusz 2005). Ostatnio (2002 r.) stwierdzony został w gospodarstwie rybackim Zarszyn (zlewnia Wisłoka), dokąd przedostał się z materiałem zarybieniowym z pobliskiego gospodarstwa rybackiego w Starzawie (Kostrzewa i in. 2004; Cieśla M. - inf. ustna,) oraz w śródpolnym stawie w okolicach Niewieścina k. Bydgoszczy (Andrzejewski i Mastyński 2004).
Prawdopodobnie gatunek ten wniknął również w dorzecze Odry (od 1997 r.?), bowiem, jak podaje Kostrzewa i in. (1999), wędkarze łowiący w zbiorniku Jeziorsko (Warta) stosowali go jako żywca do połowu drapieżników.
Liczebność populacji tego gatunku w Polsce aktualnie trudna jest do oszacowania, ale wykazuje wyraźną tendencję zwyżkującą. W niektórych regionach Polski występuje już masowo. Badania Terleckiego i Pałki (1999), prowadzone w środkowym biegu Wisły i jej niektórych małych dopływach w tym regionie (1996 r.), wykazały obecność tego gatunku w 11 na 15 stanowisk, a łączna liczba odłowionych przy pomocy siatek ryb sięgała 750. Według Wiśniewolskiego i in. (2001) w Wiśle (od ujścia Sanu po Tczew) na każdym badanym odcinku występował już ten gatunek, a jego liczebność w elektropołowach wahała się od 1 do 8 osobników w połowie. | | | | | | Występowanie na terenach chronionych | | Jak dotąd gatunek ten odnotowany został m.in. w Strzeleckim Parku Krajobrazowym, PK "Podlaski Przełom Bugu" i Kozienickim PK (środkowa Wisła). | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Z racji tego, że trawianka jest gatunkiem drapieżnym może limitować liczebność zarówno drobnych (np. słonecznica Leucaspius delineatus), jak i dużych gatunków ryb, przez wyżeranie ich ikry i stadiów narybkowych (Litvinov i O'Gorman 1996, Reshetnikov 2000, Shlyapkin i Tikhonov 2001). Potwierdzają to również dane Koščo i in. (2003) ze Słowacji - gdzie w zdominowanych już przez ten gatunek ekosystemach odnotowano spadek zróżnicowania gatunkowego i liczebności ryb. Kautman (1999, 2000) podaje, że spadek liczebności muławki dunajskiej Umbra kramer i, gatunku chronionego w Słowacji, prawdopodobnie związany jest z pojawieniem się w tym regionie trawianki. W pokarmie tego gatunku, oprócz ryb i wodnych bezkręgowców, autor ten odnotował również larwy traszek: Triturus vulgaris, T. dobrogicus. Potwierdzają to również Bogucka i Naseka (2002) oraz Manteifel i Bastakov (1986), według których trawianka często zjada kijanki żab. W Europie obecność tego gatunku niesie największe zagrożenie dla takich gatunków, jak: słonecznica, muławka dunajska, karaś i różanka - Rhodeus sericeus (Koščo i in. 2003). Niektórzy autorzy podkreślają (Berg 1949, Nikolski 1956), że może on spełniać pożyteczną rolę jako tępiciel larw komarów, ale tam, gdzie został wprowadzony, nie odnotowano widocznych w tym względzie efektów (Kirpičnikov 1945). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Trawianka wpływa wyraźnie na zmiany strukturalne w rodzimej faunie wodnej, może tym samym negatywnie oddziaływać na stan niektórych lokalnych populacji ryb i innych zwierząt wodnych. Zwalczanie - nawet gdyby przyjąć, że jest uzasadnione - byłoby trudne do przeprowadzenia, bowiem trawianka jest gatunkiem wyjątkowo odpornym na wszelkie zmiany w środowisku wodnym. W celu zapobieżenia dalszej jej ekspansji niezbędna jest staranna kontrola sprowadzanego materiału obsadowego, szczególnie z obszarów aktualnego występowania trawianki. Do dalszego rozprzestrzenienia się tego gatunku mogą przyczyniać się również wędkarze łowiący drapieżne ryby na "żywca" (Kostrzewa i in. 1999). Ryby te przywożono z nieznanych akwenów (z dorzecza Wisły?) m.in. do zbiornika Jeziorsko (środkowy bieg Warty), gdzie używane były jako przynęta w połowach drapieżników.
Bogucka i Naseka (2002) uważają, że liczebność tego gatunku może być limitowana zasobami pokarmowymi, kanibalizmem i obecnością drapieżników. Według tych autorów trawianka jest wrażliwa na chlorek wapnia (CaCl2) i zasadę amonową (NH4OH). Podkreślają jednak, że środki te mogą być zastosowane tylko w małych zbiornikach.
Gatunek nie jest objęty żadną z form ochrony. Jednym z możliwych, choć mało skutecznych działań jest zastosowanie się do rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dn. 12 listopada 2001 r. (Dz. U. 2001, Nr 138, poz. 1559, § 8 z późn. zm.) oraz Regulaminu amatorskiego połowu ryb PZW, które zakazują wpuszczania obcych gatunków ryb (w tym trawianki) do łowiska i innych wód. | | | | | | Prognoza | | Rozprzestrzenianie się tego gatunku na terenie Europy jest ułatwione z racji połączenia kanałami większości systemów rzecznych oraz uwalniania utrzymywanych osobników przez akwarystów.
Bardzo szybki sukces kolonizacyjny trawianka zawdzięcza wyjątkowej odporności na deficyty tlenowe, znaczne wahania temperatury wody oraz wysychanie i przemarzanie zbiorników (Terlecki 2000). Ma ona niezwykłą zdolność do zimowania bezpośrednio w lodzie lub osadach dennych (Sokolov 2001). Wysoką przeżywalność zawdzięcza też takim cechom biologicznym, jak wielomiotowość, sprawowana opieka nad złożoną ikrą oraz wykorzystywanie już od stadiów larwalnych bardzo zróżnicowanego pokarmu (Sikorska i in. 2007).
Trudno jest wskazać przyczyny i drogi, którymi gatunek ten dostał się do polskich wód. Wiele pośrednich informacji wskazuje, że został on zawleczony do Polski prawdopodobnie z rybami handlowymi sprowadzanymi do Polski z obszaru wschodniej Europy (Białoruś, Ukraina, Litwa), gdzie był wcześniej introdukowany (Kostrzewa i in. 1999, Witkowski i Kotusz 2005). Niewykluczone jest też samoistne przeniknięcie kanałami łączącymi systemy Wisły i Dniepru. Ostatnio tą drogą do naszych wód przedostały się dwa gatunki ryb babkowatych - Neogobius gymnotrachelus i N. fluviatilis (Danilkiewicz 1996, 1998). Być może pewien udział w rozprzestrzenieniu się trawianki mają akwaryści (Antychowicz 1994), choć nie jest to interesujący gatunek w hodowli akwaryjnej.
Przewiduje się, że trawianka w najbliższych 5-10 latach jest w stanie zasiedlić większość nizinnych obszarów Polski. Gatunek ten prawdopodobnie już przeniknął do wschodniej części dorzecza Odry. W najbliższym czasie prawdopodobnie zasiedli środkowy i dolny bieg tej rzeki. Poprzez kanały łączące Odrę ze Szprewą, Havelą, Łabą i innymi systemami rzecznymi zachodniej Europy jest w stanie w okresie 10-15 lat samoczynnie opanować i tę część kontynentu. W najbliższym czasie należy spodziewać się inwazji tego gatunku również od południowego-wschodu przez połączenia Dunaj-Men-Ren (Freyhof 2003). Według Kautmana (2000) z dorzecza Cisy trawianka prawdopodobnie przedostanie się do Dunaju i w krótkim czasie może zasiedlić obszar Austrii i Niemiec. Z tej rzeki ma duże możliwości rozprzestrzenienia poprzez kanały łączące inne systemy rzeczne zachodniej Europy. Harka i Farkas (1998) podają, że gatunek ten w latach 60. był hodowany przez niemieckich akwarystów, można więc przypuszczać, że niekiedy był przez nich uwalniany do wód otwartych. | | | | | | Literatura | | - Andrzejewski W., Mastyński J. 2004. Nowe stanowisko trawianki (Perccottus glenii Dybowski, 1877). Komunikaty Rybackie 2: 22-23.
- Antychowicz J. 1994. Percottus glehni w naszych wodach. Komunikaty Rybackie 2: 21-22.
- Berg L.S. 1949. Ryby presnych vod SSSR i sopredelnych stran. Izdatielstvo Akademii Nauk SSSR, Moskva-Leningrad 2: 477- 925.
- Błachuta J., Błachuta J., Kusznierz J. 2002. Ichtiofauna Bugu. W: A. Dąbrowski i in. (red.) Korytarz ekologiczny doliny Bugu. Stan - Zagrożenia i Ochrona. Fundacja IUCN Polska, Warszawa: 168-183.
- Bogucka N.G., Naseka A.M. 2002. Perccottus glenii Dybowski, 1877. Freshwater Fishes of Russia, Zoological Institute RAS. http://www.zin. ru/Animalia/Pisces/taxbase e/ species_elperccottus_el.htm.
- Boznak E.I. 2004. Gołowieszka-rotan Perccottus glenii (Eleotridae) iz bassejna reki Vyčegda. Voprosy Ichtiologii 44: 712-713.
- Danilkiewicz Z. 1996. Babka łysa (gołogłowa), Neogobius gymnotrachelus (Kessler, 1857) Perciformes, Gobiidae - nowy gatunek w ichtiofaunie zlewiska Morza Bałtyckiego. Komunikaty Rybackie 2: 27-29.
- Danilkiewicz Z. 1998. Babka szczupła, Neogobius fluviatilis (Pallas, 1811), Perciformes, Gobiidae - nowy, pontyjski element w ichtiofaunie zlewiska Morza Bałtyckiego. Fragmenta Faunistica 41: 269-277.
- Diripasko O. 1996. Piervyj słučaj poimki byčka-rotana Percottus glenii (Eleotridae) v Kaliningradskoj oblasti. Voprosy Ichtiologii 36: 842.
- Dmitrijev A.T. 1971. Ostorožno rotan. Rybovodstvo i Rybolovstvo 1: 26-27.
- Elovenko V.N. 1981. Taxonomic status and geographical distribution of the eleotridid fish (Eleotridae, Gobioidei, Perciformes) introduced in water bodies of the European part of the SSSR, Kazachstan and Middle Asia. Zoologičeskij Žurnal 60: 1517-1522.
- Freyhof J. 2003. Immigration and potential impacts of invasive freshwater fishes in Germany. Institut für Gewässerökologie und Binnenfischerei (Berlin) - "Regulation of biocoenoses": 51-58.
- Gergely J., Tucakov M. 2003. Az amurgeb (Perccottus glenii Dybowski, 1877) else elefordualsa a Vojdasagban. Halaszat 96: 158-160.
- Gluchovec I.V., Durkavec G.M. 1987. Taxonomy, morphology and ecology of a member of Eleotridae Gobioidei, Perciformes) acclimatized in the Balkhash-Ili basin. Journal of Ichthyology 27: 80-88.
- Harka A. 1998. New fish species in the fauna of Hungary: Perccottus glehni Dybowski, 1877. Halaszat 91: 32-33.
- Harka A., Farkas J. 1998. Ausbreitung von fernöstlichen Perccottus glenii nach Europa. Österreichs Fischerei 51: 11-12.
- Harka A., Sallai Z. 1999. Az Amurgeb (Perccottus glehni Dybowski, 1877) morfológiai jellemzése, élőhelye és terjedése Magyarorszagon. Halaszat 90: 33-36.
- Hoese D.F., Gill A.C. 1993. Phylogenetic relationships of eleotridid fishes (Perciformes: Gobioidei). Bulletin Marine Sciences 52: 415-440.
- Kakareko T. 1999. Perccottus glenii (Odontobutidae) - nowy gatunek ryby w Zbiorniku Włocławskim na Dolnej Wiśle. Przegląd Zoologiczny 42: 107-110.
- Kautman J. 1999. Perccottus glenii Dybowski, 1877 vo vodach vychodneho Slovenska. Chranene Uzeme Slovenska 40: 20-22.
- Kautman J. 2000. Tri nove druhy ryb na Slovensku. Biodiverzita Ichtyofauny ČR 3: 29-36.
- Kirpičnikov V.S. 1945. Biologia Perccottus glehni Dyb. (Eleotridae). Biulletin Moskovskogo Obščestva. Ispytatelei Prirody, Otdiel Biologičeskii 5-6: 14-26.
- Kostrzewa J., Marszał L., Tłoczek K. 1999. Czy trawianka Percottus glehni Dyb. ma szanse stać się trwałym elementem polskiej ichtiofauny? Chrońmy Przyrodę Ojczystą 5: 98-101.
- Kostrzewa J., Grabowski M., Zięba G. 2004. Nowe inwazyjne gatunki ryb w wodach Polski. Archiwum Rybactwa Polskiego 12 (suppl. 2): 21-34.
- Koščo J., Košuth P. 2002. Výskyt Ictalurus melas Rafinesque, 1820 a Perccottus glenii Dybowski, 1877 na východnim Slovensku. Biodiverzita Ichthyofauny ČR 4: 105-108.
- Koščo J., Košuth P., Hrtan E. 1999. Further new fish element of fishes in Slovakia; Amur sleeper. Polovnictvo a Rybarstvo 51: 33.
- Koščo J., Lusk S., Halačka K., Luskova V. 2003. The expansion and occurrence of the Amur sleeper (Perccottus glenii) in eastern Slovakia. Folia Zoologica 52: 329-336.
- Kozlov V.I. 1993. Ecological prediction of ichthyofauna of fresh waters (by the example of Ponto-caspian region). Vsesojuznyj Naučno-Issledovatielnyj Institut Ozernogo i Rybnogo Chozajstva, Moskva: 1-252.
- Kuderskij L.A. 1980. Rotan in the Gorky district ponds. Rybochozajstvo Iz. Vnutriennych Vodojemov 25: 28-33.
- Litvinov A.G., O'Gorman R. 1996. Biology of Amur sleeper (Perccottus glehni) in the delta of the Selenga River, Buryatia, Russia. Journal of Great Lakes Researches 22: 370-378.
- Lusk S., Koščo J., Luskova V., Halačka K., Košuth P. 2004. Alien fish species in the floodplains of the Dyje and the Bodrog rivers. Ecohydrology & Hydrobiology 4: 199-205.
- Manteifel Y.B., Bastakov V.A. 1986. Percottus glehnii Dybowski - a new colonizer in the ichthyofauna of Lake Glubokoe. Hydrobiologia 141: 133-134.
- Moshu Y.A., Guzun A.A. 2002. The first discovery of rotan Perccottus glenii (Perciformes: Odontobutidae) in Dniestr River. Vestnik Zoologii 36: 98.
- Movčan Y.V. 1989. The fisrt record of Percottus glehnii Dybowski (Pisces, Eleotridae ) in the water bodies of the Ukraine. Vestnik Zoologii 5: 87.
- Nelson J.S. 1994. Fishes of the World. 3-rd ed. J. Wiley & Sons, New York-Chichester- Brisbane-Toronto-Singapore: 1-600.
- Nikolski G.W. 1956. Ryby bassejna Amura. Izdatielstvo Akademii Nauk SSSR, Moskva: 1-551.
- Nikolski G.W. 1970. Ichtiologia szczegółowa. Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa: 1-546.
- Pietraszewski D., Grabowska J. 2007. Dymorfizm płciowy u trawianki (Perccottus glenii). Ogólnopolski Kongres Zoologiczny, Olsztyn, 12-16.09.2007: 99.
- Pietraszewski D., Grabowska J., Marszał L. 2007. Biologia rozrodu trawianki (Perccottus glenii). Ogólnopolski Kongres Zoologiczny, Olsztyn, 12-16.09.2007: 100.
- Plikšs M., Aleksejevs E. 1998. Zivis. Gandrs - Riga: 1-304.
- Rešetnikov Y.S. (ed.). 1998. Annotirovanyj katalog krugłorotnych i ryb kontinentalnych vod Rossii. Izdatielstvo Nauka, Moskva: 1-220.
- Reshetnikov A.N. 2000. Species diversity of aquatic animals (Invertebrates, Amphibians and Fishes) in ponds and the effect of predation by the introduced rotan (Perccottus glenii). Biodiversity and dynamics of ecosystems in North Eurasia, Novosibirsk 3: 279-281.
- Shlyapkin I.V., Tikhonov S.V. 2001. Distribution and biological features of Amur sleeper Perccottus glenii Dybowski in the upper Volga reservoirs. U.S. - Russia invasive species workshop Borok, Book of Abstracts: 201-202.
- Sideleva V.G. 2001. List of fishes from Lake Baikal with descriptions of new taxa of cottoid fishes. New Contributions Freshwater Fish Researches, St. Petersburg 287: 45-79.
- Sikorska J., Wolnicki J., Kamiński R. 2007. Czym skorupka za młodu nasiąknie, czyli ABC wczesnego rozwoju trawianki Perccottus glenii. Komunikaty Rybackie 3: 22-26.
- Sokolov L. I. 2001. On wintering of Perccottus gleniiin the water-bodies of the Amur River. Voprosy Ichtiologii 41: 572-573.
- Spanovskaja V.D., Savvaitova K.A., Potanova T.L. 1964. Ob izmenčivosti rotana (Perccottus glehni Dyb., fam. Eleotridae pri akklimatizacii. Voprosy Ichtiologii 4: 632-643.
- Terlecki J. 2000. Trawianka - Percottus glenii Dybowski, 1877. W: Brylińska M. (red.). Ryby słodkowodne Polski. Państwowe Wydawnictwo Naukowe, Warszawa: 476-479.
- Terlecki J., Pałka R. 1999. Occurrence of Perccottus glenii Dybowski 1877 (Perciformes, Odontobutidae) in the middle stretch of the Vistula river, Poland. Archiwum Rybactwa Polskiego 7: 141-150.
- Travkina G.L. 1997. Osobennosti oogeneza i dinamiki razvitja oocitov u rotana-goloveški Percottus glehni Dyb. Trudy Biologii Naučno-Issledovatielnego Instituta 44: 29-38.
- Witkowski A. 2002. Introduction of fishes into Poland: benefaction or plague. Nature Conservation 59: 41-52.
- Witkowski A., Kotusz J. 2005. The expansion of the Amur sleeper Perccottus gleni Dybowski 1877 (Perciformes, Odontobutidae) in Poland. Ichthyology 00: 000-000.
- Wiśniewolski W., Borzęcka I., Buras P., Szlakowski J., Woźniewski M. 2001. Ichtiofauna dolnej i środkowej Wisły. Roczniki Naukowe Polskiego Związku Wędkarskiego 14 (suppl.): 137-155.
- Woźniewski M. 1997. Trawianka - nowy gatunek ryby w Wiśle. Wiadomości Wędkarskie 12: 69.
| | | | | | Streszczenie | | The homeland of Amur Sleeper is Far East where it occurs from the Ochockie Sea to Korean Peninsula and the Yellow Sea, the Amur drainage basin, NW Sachalin, Chanka lake and the environs of Port Arthur. It was brought to Europe in 1912 from the Amur drainage basin and released in the environs of St. Petersburg. For the second time it was brought to Moscov in 1948. During subsequent years it was spreading from these places towards Western and Southern Europe owing to human activity (accidental introductions, activity of aquarists) and naturally via river systems. Beyond the European part of Russia and Kaliningrad Province it was noted in Estonia, Ukraine, Hungary, Slovakia, Poland and Yugoslavia/Serbia.
In Poland it was first found in 1993, in the central part of the Vistula drainage basin (environs of Kazimierz). Up to now about 30 locations have been noted, mainly in the eastern part of the Vistula drainage basin and in its estuarial part. The presence of Amur Sleeper in the Odra drainage basin (eastern part) is highly probable.
In both its native range and areas of introduction Amur Sleeper inhabits slowly flowing and stagnant waters, primarily strongly overgrown shallow lakes, ox-bow lakes, ponds and small pools. In water reservoirs where fish-kill events are a frequent phenomenon Amur Sleeper is often the only representative of the ichthyofana. Colonization success of this species is related to its exceptional tolerance to low oxygen, drying up and freezing of water and such biological features as the prolonged spawning, multi-litter spawning, guarding of spawned eggs/protection of the clutch).
Amur Sleeper is a predatory fish; it may reduce numbers of both small and big fish through predation on their spawn and juvenile stages. In many regions of Southern Europe a well-marked decline in species diversity and numbers of fish was observed in water bodies dominated by P. glenii. The control of Amur Sleeper is difficult because this species is exceptionally resistant to any change in the water environment. | | | | | | Opracowanie | | Andrzej Witkowski | | | | |
|