
Neogobius gymnotrachelus (Kessler, 1857)
babka łysa
Racer Goby |   | Rodzina | | Gobiidae babkowate | | Rząd | | Perciformes okoniokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
 | | | | | | Locus typicus/Terra typica | | Dniestr i jego dopływy. | | | | | | Pierwotna ojczyzna gatunku | | Gatunek ten należy do reliktowej fauny ponto-kaspijskiej sprzed połączenia Morza Czarnego z M. Śródziemnym. Występuje w lekko zasolonych estuariach u wybrzeży Morza Czarnego i M. Azowskiego oraz w dolnych odcinkach rzek stanowiących ich zlewisko, tj. w Dunaju po Żelazną Bramę, w Dniestrze, Bohu, Dnieprze, Donie, Kubaniu oraz rzekach spływających z Kaukazu. W Turcji notowana w rejonie Morza Marmara i rzece Sakarya. Zamieszkuje również przybrzeżne jeziora, ponadto przybrzeżne wody Morza Kaspijskiego w części północnej, zachodniej i wschodniej, ale nie wchodzi do uchodzących tam rzek. | | | | | | Podstawowe cechy morfologiczne | | Samce dorastają maksymalnie do 160 mm, samice do 133 mm, osobniki spotykane w Polsce są przeciętnie mniejsze. Ubarwienie żółtawo-szare. Grzbiet ciemny z ukośnie biegnącymi brunatnymi falistymi pasami. Duże oczy na wierzchu głowy, stanowiącej 1/4 długości ciała. Pysk tępo zakończony. Otwór gębowy szeroki w ustawieniu półgórnym z mięsistymi wargami. Płetwy brzuszne zrośnięte w przyssawkę osadzoną pod płetwami piersiowymi. Pierwsza płetwa grzbietowa krótsza i wyższa od drugiej. Druga płetwa grzbietowa równo wysoka na całej długości, tak samo odbytowa. Ciało całkowicie pokryte łuską (ktenoidalną i, miejscami, cykloidalną) z wyjątkiem sklepienia głowy, gardła i podstawy płetw piersiowych. W okresie rozrodu ciało samca ciemnieje, a płetwy wydłużają się i czernieją. | | | | | | Biologia, ekologia | | Żyje do 4-5 lat. Dojrzałość płciową osiąga w wieku dwóch lat (Pinchuk i in. 2003, za Georghievem 1966). Płodność skorelowana jest z wielkością samicy i średnio wynosi 1000 jaj na samicę. Średnica jaj w okresie bezpośrednio poprzedzającym rozród waha się od 0,14 mm do 1,56 mm (Grabowska 2005). Tarło trwa od początku kwietnia do końca lipca, czasem przedłuża się do połowy sierpnia. Jaja składane są w co najmniej dwóch rzutach, w miejscach osłoniętych, tzw. gniazdach, pod korzeniami i kamieniami, w pustych muszlach małży Anodonta sp., w oponach i innych wyrzucanych do wody śmieciach. W gnieździe mogą się znaleźć jaja od więcej niż jednej samicy. Ikra pilnowana jest przez samca, który ruchami płetw natlenia wodę, usuwa obumarłe jaja i odstrasza potencjalnych drapieżników.
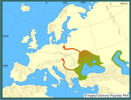
Babka łysa jest organizmem euryoligohalinowym, żyje zarówno w wodach słodkich, jak i w wysłodzonych zatokach morskich (Pinchuk i in. 2003). Szczególnie dobre warunki bytowania znalazła w zbiornikach zaporowych, gdzie obserwuje się ją w dużej liczebności. W Polsce spotykana w rzekach, gdzie preferuje miejsca odsunięte od głównego nurtu, np. zamulone zatoki, często z dużą liczbą mięczaków, oraz w zbiornikach zaporowych. Wiosną migruje do strefy przybrzeżnej dla odbycia tarła, a na zimę powraca na większe głębokości. Rozprzestrzenianiu tego gatunku sprzyja oportunistyczna strategia żerowania, tzn. skład pokarmu zależy od dostępnej bazy pokarmowej (Kostrzewa i Grabowski 2003). W Polsce żywi się głównie skorupiakami obunogimi Amphipoda, larwami ochotek Chironomidae i innych muchówek Diptera, mięczakami Molusca (np. Valvata sp., Bithynia sp., Sphaerium sp., Pisidium sp., Dreissena polymorpha) oraz skąposzczetami Oligochaeta (Grabowska i Grabowski 2005, Kakareko i in. 2005). Żeruje w nocy i o świcie (Grabowska i Grabowski 2005). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Babka łysa rozprzestrzenia się w Europie wzdłuż dwóch szlaków migracji wodnej fauny ponto-kaspijskiej wskazanych przez Bij de Vaate i in. (2002). Jeden z nich, tzw. centralny, prowadzi z Morza Czarnego przez Dniepr, Prypeć, Kanał Królewski i Muchawiec (dopływ Bugu) do Polski, a stąd możliwa jest dalsza ekspansja przez Kanał Bydgoski, Noteć, Odrę do Niemiec i Zachodniej Europy. Pojawienie się babki łysej na obszarze Polski w 1995 r. poprzedzone było wcześniejszym rozszerzeniem jej zasięgu w dorzeczu Dniepru, aż po Kijów (Smirnov 1998), podczas gdy jeszcze w XIX w. notowana była jedynie w jego dolnym biegu. Obecnie występuje również na liście obcych gatunków na Białorusi.
Ekspansja babki łysej obserwowana jest również wzdłuż Dunaju (tzw. kanał południowy, wg Bij de Vaate i in. 2002), powyżej Żelaznej Bramy, uważanej za granicę pierwotnego zasięgu babki. Na początku lat 90. odnotowano ją w Serbii (Hegediš i in. 1991), gdzie obecnie występuje na kilku stanowiskach w Dunaju, m.in. na 130. kilometrze powyżej Żelaznej Bramy (Visnjic-Jeftic, Hegediš 2004). W 1999 r. złowiono ją na Słowacji w okolicach Bratysławy (Kautman 2001) i w Austrii na wschód od Wiednia (Ahnelt i in. 2001). Jak dotąd nie stwierdzono jej obecności na Węgrzech.
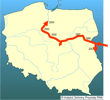
To rozprzestrzenianie się, zwłaszcza w Dunaju i Dnieprze, częściowo ma charakter naturalnej dyspersji z dawnego postglacjalnego refugium, ale udział tzw. czynnika ludzkiego jest tu wyraźny, przejawiający się m.in. w budowie kanałów żeglugowych łączących zlewiska mórz. Babka łysa, jako denna ryba słabo pływająca na duże odległości, najprawdopodobniej wykorzystuje w swej inwazji transport rzeczny, przemieszczając się skokowo o setki kilometrów np. w wodach balastowych, w zagłębieniach mat peryfitonu porastających zanurzone części lub w postaci ikry przyczepionej do elementów statku (Ahnelt i in. 1998). Wskazują na to również badania z okolic Wiednia (Wiesner 2005), gdzie babki szczególnie licznie zasiedlają rejony umocnień naddunajskich portów. Ten pogląd na rozprzestrzenianie się babki łysej potwierdza też jej nieciągły zasięg - obecna jest na Słowacji i w Austrii, podczas gdy - jak do tej pory - nie złowiono jej na Węgrzech. Możliwe, że również komunikacja rzeczna przyczyniła się do jej dyspersji np. w dorzeczu Dniepru. Rozprzestrzenianiu tego gatunku sprzyjają również określone cechy jego biologii. Po pierwsze, jak wszystkie ponto-kaspijskie babkowate charakteryzuje się szerokim zakresem tolerancji na czynniki środowiskowe, a zwłaszcza zasolenie. Oportunistyczna strategia żerowania i szerokie spektrum diety pozwalają zasiedlać nowe siedliska bez względu na dostępną bazę pokarmową (Kostrzewa, Grabowski 2003; Kakareko i in. 2005). Podobnie behawior rozrodczy, tj. wielomiotowe tarło, ikra składana w ukryciu i pilnowana przez samca, wydaje się sprzyjać wysokiej reprodukcji babki łysej, a w konsekwencji jej ekspansji (Grabowska 2005). | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Babka łysa po raz pierwszy stwierdzona została w 1995 r. w środkowym Bugu na odcinku Terespol-Drohiczyn (Danilkiewicz 1996), a dwa lata później gatunek ten występował już w tej rzece między miejscowościami Hanna i Kamieńczyk, przypuszczalnie zasiedlił też Zalew Zegrzyński (Danilkiewicz 1998). Następnie w 2000 r. odnotowano obecność babki łysej w Zbiorniku Włocławskim, oddalonym od ujścia Bugo-Narwi do Wisły o około 100 km (Kostrzewa, Grabowski 2001). W 2003 r. babka ta już licznie występowała w okolicach Torunia (Kakareko i in. 2005) i Solca Kujawskiego (Grabowska i Grabowski 2005), potwierdzono jej obecność także w Bugu poniżej Kodenia i w Zalewie Zegrzyńskim (Kostrzewa i in. 2004). Jesienią 2005 r. złowiono ją w ujściu Wdy, tj. na 813,5 km biegu Wisły (Grabowski M. - inf. ustna). Zaobserwowano, że babka łysa wchodzi do ujściowych odcinków dopływów Wisły, np. Bzury (Zięba 2006), Skrwy Prawej (Marszał i in. 2004) i Wdy. W 2007 potwierdzono, że gatunek ten utrzymuje się w Bugu na odcinku Terespol-Zalew Zegrzyński oraz dolnej Wiśle w Zbiorniku Włocławskim (Grabowska - obserwacja własna), stwierdzono go również w Przekopie Wisły (Błażuk - inf. ustna). | | | | | | Występowanie na terenach chronionych | | W 2003 r. obecność babki łysej stwierdzono na terenie Brudzeńskiego Parku Krajobrazowego; kilka osobników złowiono wówczas na dwóch stanowiskach w Skrwie Prawej oddalonych o 2 i 6 km od ujścia do Wisły (Marszał i in. 2004). Gatunek ten występuje również w Bugu na odcinkach wchodzących w skład Parku Krajobrazowego "Podlaski Przełom Bugu" oraz Nadbużańskiego Parku Krajobrazowego (Kostrzewa i in. 2004). Ponieważ babka łysa dotarła w Wiśle do ujściowego odcinka, prawdopodobnie jest również w Zespole Nadwiślańskich Parków Krajobrazowych. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Potencjalnie babka łysa może konkurować o pokarm z rodzimymi gatunkami ryb, jednak problemu takiego nie ma tam, gdzie baza pokarmowa jest wystarczająco bogata, jak np. w zbiornikach zaporowych. Wstępne porównanie pokarmu jazgarza Gymnocephalus cernuus, okonia Perca fluviatilis i babki łysej w Zbiorniku Włocławskim wykazało niski współczynnik nakładania się diety (Grabowska i Grabowski 2005). Zagrożenie w postaci wyjadania ikry i narybku krajowych ryb jak na razie nie zostało wykazane; przykładowo ten rodzaj pokarmu tylko sporadycznie występował w przewodach pokarmowych babki łysej ze Zbiornika Włocławskiego (Grabowska i Grabowski 2005, Kakareko i in. 2005). Natomiast kilkakrotnie odnotowano obecność w pokarmie babki rzadkiego ślimaka Valvata naticina (Kostrzewa i Grabowski 2003), co nie oznacza, że babka wybiera właśnie ten gatunek. Babka łysa może być wektorem nowych gatunków pasożytów z rejonu ponto-kaspijskiego. Badania parazytologiczne przeprowadzone w 2006 r. wykazały obecność obcego dla naszej fauny gatunku ektopasożytniczego płazińca, tj. Gyrodactylus proterorhini u osobników złowionych w okolicach Torunia (Ondračkova - inf. ustna). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Nie jest to gatunek ekologicznie czy gospodarczo uciążliwy w krajowych wodach, brak też informacji o próbach jego zwalczania. Populacje wystawione są na drapieżnictwo m.in. takich gatunków jak sandacz Stizostedion lucioperca, sum Silurus glanis, czy miętus Lota lota (w ich żołądkach znajdowano babki łyse), jak też kormoran Phalacrocrax carbo, który w Zalewie Wiślanym i Zatoce Puckiej z powodzeniem poluje na babkę byczą Neogobius melanostomus (Bzoma 1998).
Gatunek nieobjęty w Polsce żadną formą ochrony. | | | | | | Prognoza | | W najbliższych latach babka łysa prawdopodobnie będzie w Polsce migrować dalej na zachód Kanałem Bydgoskim, łączącym Wisłę z Notecią i dorzeczem Odry, a następnie dalej do Niemiec poprzez system kanałów. Badania prowadzone w październiku 2003 r. nie wykazały jeszcze obecności tego gatunku ani w Kanale Bydgoskim ani w Noteci (obserwacje własne). | | | | | | Literatura | | - Ahnelt H., Bănărescu P.M., Spolwind R., Harka Á., Waidbacher H. 1998. Occurence and distribution of three gobiid species (Pisces, Gobiidae) in the middle and upper Danube region - examples of different dispersal patterns? Biologia 53 (5): 665-678.
- Ahnelt H., Duchkowitsch M., Scattolin G. 2001. Neogobius gymnotrachelus (Kessler, 1857) (Teleostei: Gobiidae), die Nackthals-Grundel in Österreich. Österreichs Fischerei 54: 262-266.
- Bij de Vaate A., Jażdżewski K., Ketelaars H., Gollasch S., Van der Velde G. 2002. Geographical patterns in range expansion of macroinvertebrate Ponto-Caspian species in Europe. Canadian Journal of Fisheries and Aquatic Sciences 59: 1159-1174.
- Bzoma S. 1998. The contribution of round goby (Neogobius melanostomus Pallas, 1811) to the food supply of cormorants (Phalacrocorax carbo Linnaeus, 1758) feeding in the Puck Bay. Bulletin of the Sea Fisheries Institute 2 (144): 3947.
- Danilkiewicz Z. 1996. Babka łysa (gołogłowa), Neogobius gymnotrachelus (Kessler, 1857) Perciformes, Gobiidae - nowy gatunek w ichtiofaunie zlewiska Morza Bałtyckiego. Komunikaty Rybackie 2: 27-29.
- Danilkiewicz Z. 1998. Babka szczupła, Neogobius fluviatilis (Pallas, 1811), Perciformes, Gobiidae - nowy, pontyjski element w ichtiofaunie zlewiska Morza Bałtyckiego. Fragmenta Faunistica 41 (21): 269-277.
- Grabowska J. 2005. Reproductive biology of racer goby Neogobius gymnotrachelus in the Włocławski Reservoir (Vistula River, Poland). Journal of Applied Ichthyology 21 (4): 296-299.
- Grabowska J., Grabowski M. 2005. Diet-feeding activity in early summer of racer goby Neogobius gymnotrachelus (Gobiidae): a new invader in the Baltic basin. Journal of Applied Ichthyology 21: 282-286.
- Hegediš A., Nikčević M., Mićković B., Janković D., Andjus R.K. 1991. Discovery of the goby Neogobius gymnotrachelus in Yugoslav fresh waters. Arhiv Bioloskich Nauka, Belgrad, 43: 39-40.
- Kakareko T., Żbikowski J., Żytkowicz J. 2005. Diet partitioning in summer of two syntopic neogobiids from two different habitats of the lower Vistula River, Poland. Journal of Applied Ichthyology 21: 292-295.
- Kautman J. 2001. The first occurrence of Neogobius gymnotrachelus (Pisces, Gobiidae) in Slovak Danube. Folia Zoologica 50: 79-80.
- Kostrzewa J., Grabowski M. 2001. Babka łysa (gołogłowa), Neogobius gymnotrachelus (Kessler, 1857) (Gobiidae, Perciformes) - nowy gatunek ryby w Wiśle. Przegląd Zoologiczny 45 (1-2): 101-102.
- Kostrzewa J., Grabowski M. 2003. Opportunistic feeding strategy as a factor promoting the expansion of racer goby (Neogobius gymnotrachelus Kessler, 1857) in the Vistula basin. Lauterbornia 48: 91-100.
- Kostrzewa J., Grabowski M., Zięba G. 2004. Nowe inwazyjne gatunki ryb w wodach Polski. Archives of Polish Fisheries 12 (Supplement 2): 21-34.
- Marszał L., Zięba G., Przybylski M., Grabowska J., Kaczkowski Z. 2004. Monitoring ichtiofauny systemu rzecznego Skrwy Prawej. Roczniki Naukowe Polskiego Związku Wędkarskiego 17: 77-98.
- Pinchuk V.I., Vasil'eva E.D., Vasil'ev V.P., Miller P. 2003. Neogobius gymnotrachelus (Kessler, 1857). W: Miller P. J. (red.) The Freshwater Fishes of Europe. Vol. 8/I Mugilidae, Atherinidae, Atherionopsidae, Blennidae, Odontobutidae, Gobiidae 1. AULA-Verlag: 264-279.
- Visnjic-Jeftic Z., Hegediš M. 2004. New data of the distribution of the gobies (gen. Neogobius, fam. Gobiidae) in Serbian course of the Danube River. In: Saat T. (ed.) Proceedings of XI European Congress of Ichthyology, Tallinn, 5-9 September 2003: 1-200.
- Wiesner C. 2005. New records of non-indigenous gobies (Neogobius sp.) in the Austrian Danube. Journal of Applied Ichthyology 21: 324-327.
- Zięba G. 2006. Struktura zespołów ryb systemu rzeki Bzury na tle czynników środowiskowych. Rozprawa doktorska, Katedra Ekologii i Zoologii Kręgowców, Uniwersytet Łódzki.
| | | | | | Streszczenie | | Racer goby, Neogobius gymnotrachelus (Kessler, 1857) naturally occurs in estuaries of Black and Azov seas and lower sections of their rivers: Danube (up to the Iron Gate), Dniestr, Dnieper, Southern Bug, Don, Kuban and Caucasian rivers. In Turkey it was noted in the Marmara Sea and the Sakarya River. It inhabited coastal waters of the northern, western and eastern parts of the Caspian Sea but was not reported from its rivers.
It spread in Europe through two out of the three main invasion corridors. The southern corridor goes along the Danube to the Rhine River. Till now Racer Goby crossed the Iron Gate and at the beginning of the 1990s was recorded in the Serbian part of the Danube. In 1999 it was caught in Slovakia near Bratislava and in Austria near Vienna. The second route of invasion, the so-called central corridor, goes through the Dnieper and Pripiat rivers (the Black Sea basin) that are connected with the Vistula River system (the Baltic Sea basin) by the Pripiat-Bug canal. In Poland it was first recorded in 1995 in the middle stretch of the Bug River (Western Bug), the tributary of Vistula River, then in 2000 it was noted in the Włocławek Reservoir (lower Vistula River) and till 2007 it almost reached the Vistula River mouth and entered some lower stretches of the Vistula and Bug River tributaries. Its westward invasion is expected through the Bydgoszcz Canal to the Odra River catchment and farther to Germany. As it is a euryhaline species its expansion from the Vistula River to the coastal waters of the Baltic Sea is also probable.
The invasion of Racer Goby as well as of other Ponto-Caspian gobies is a combination of natural colonization and passive dispersal via water transport, supported by man-made changes in lotic ecosystems e.g. damming, alteration of river banks. Moreover, the Ponto-Caspian gobies have several biological traits that seem to facilitate their invasion, i.e. phenotypic plasticity, effective reproductive tactics, opportunistic feeding strategy and low parasite loads.
Its impact on native ecosystems is unknown. It can reduce food resources for native fish species and compete with them if food is limited. In the Włocławek Reservoir, where food is abundant, diet overlap with native Percidae was very low. A negative influence on native fish reproductive success is possible through predation on their eggs and fry. The other threat is that this species could be a vector of exotic parasites; e.g. Gyrodactylus proterorhini was found in individuals from the Vistula River in the vicinity of the town of Toruń.
There is no information about actions undertaken to prevent its spread or eradicate it from Polish waters. Its abundance may be regulated by native predators like pike, wels, burbot and cormorants. | | | | | | Opracowanie | | Joanna Grabowska | | | | |
|