
Neogobius fluviatilis (Pallas, 1811)
babka szczupła
Racer Goby |   | Rodzina | | Gobiidae babkowate | | Rząd | | Perciformes okoniokształtne | | Gromada | | Pisces/Actinopterygii ryby promieniopłetwe | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
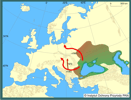
 | | | | | | Locus typicus/Terra typica | | Estuaria Morza Czarnego i Kaspijskiego. | | | | | | Pierwotna ojczyzna gatunku | | N. fluviatilis jest przedstawicielem reliktowej fauny ponto-kaspijskiej z okresu poprzedzającego ostateczne połączenie się Morza Czarnego z M. Śródziemnym (Ahnelt i in. 1998). Naturalnie występuje w wysłodzonych zatokach mórz: Czarnego i Azowskiego oraz w uchodzących do nich rzekach i ich dopływach, tj. w Dunaju po Żelazną Bramę, w Dniestrze, Bohu, Dnieprze, Donie, Kubaniu oraz rzekach spływających z terytorium Gruzji i Turcji. Zamieszkuje również przybrzeżne jeziora. Brak jednoznacznej informacji, jakie odcinki powyższych systemów rzecznych należą do pierwotnego zasięgu babki szczupłej, a które zasiedlone zostały w ostatnim stuleciu. Generalnie uważa się, że jeszcze w pierwszej połowie XIX w. jej zasięg ograniczał się do dolnego i środkowego biegu tych rzek. Gatunek występuje ponadto w strefie przybrzeżnej Morza Kaspijskiego oraz w deltach uchodzących tam rzek, m.in. Wołgi i Uralu. | | | | | | Podstawowe cechy morfologiczne | | Samce dorastają maksymalnie do 195 mm, samice do 128 mm. Ubarwienie jasne, żółtawo-beżowe, skóra półprzezroczysta. Grzbiet z szaro-brązowymi nieregularnymi plamami tworzącymi marmurkowaty wzór. Z boku ciała wyraźny rząd czarnych plam. Oczy na wierzchu głowy, stanowiącej 1/4 długości ciała. Pysk ostro zakończony, płetwy brzuszne zrośnięte w przyssawkę. Wysokość drugiej płetwy grzbietowej zmniejsza się ku tyłowi, tak samo odbytowej. Ciało pokryte ktenoidalną i miejscami cykloidalą łuską. Łuski u babki szczupłej, w odróżnieniu od babki łysej, występują również na sklepieniu głowy. W okresie rozrodu ciało samca ciemnieje do barwy prawie czarnej. | | | | | | Biologia, ekologia | | Żyje maksymalnie 5-6 lat, choć w niektórych rejonach pierwotnego zasięgu tego gatunku długość życia nie przekracza 3-4 lat (Pinchuk in. 2003). Dojrzałość płciową osiąga w 2-3 roku życia. Płodność zależy od wielkości samicy i różni się w poszczególnych rejonach naturalnego zasięgu, jednak w większości średnia liczba jaj w gonadach przekracza 1000 sztuk. Sezon rozrodczy w dolnym Dnieprze trwa od kwietnia do czerwca, w rejonach chłodniejszych przesunięty jest o miesiąc (maj-lipiec) (Pinchuk i in. 2003). Tarło odbywa się w płytkiej wodzie od 0,3 do 1,0 m (wyjątkowo do 2,3 m). Ikra składana jest na spodniej stronie różnego rodzaju zanurzonych obiektów, zarówno pochodzenia naturalnego (kamienie, korzenie, kłody, kępy roślinności), jak i antropogenicznego (kawałki metalu, liny itp.). Gniazda pilnuje samiec. Odstrasza drapieżniki i prowadzi zabiegi pielęgnacyjne nad ikrą. Liczba jaj w gnieździe wskazuje, że pochodzą one od więcej niż jednej samicy. Tarło odbywa się zazwyczaj w więcej niż jednym rzucie. Babka szczupła jest organizmem euryhalinowym, żyje w wodach słodkich, jak i w morzach, gdzie notowana była nawet przy zasoleniu 47‰. Preferuje podłoże piaszczyste (potrafi zagrzebać się wystawiając jedynie koniec pyska i oczy). W rzekach (np. w Dnieprze i Dunaju) unika głównego nurtu, wybiera miejsca raczej o umiarkowanym lub wolnym przepływie (Pinchuk i in. 2003), choć w Bugu wielokrotnie obserwowana była również w bystrzach, podobnie w Serbii zasiedliła liczne potoki o szybko płynącej wodzie (Janković 1996). Szczególnie dużą liczebność babka szczupła osiąga w zbiornikach zaporowych. Zimę spędza w głębszych wodach, a wiosną przed tarłem powraca na płycizny.
Spektrum pokarmowe tego gatunku jest bardzo duże, choć w wielu przypadkach podkreśla się znaczny udział mięczaków w pokarmie. Dieta zmienia się w zależności od wieku, sezonu i dostępnej bazy pokarmowej. W rzekach babka szczupła żywi się głównie larwami ochotek Chironomidae, drobnymi skorupiakami (głównie obunogi Amphipoda), mięczakami i rzadziej rybami, udział dwóch ostatnich kategorii wzrasta z wiekiem (Pinchuk i in. 2003, Kakareko i in. 2005, Grabowska i Grabowski 2006). U osobników złowionych w miejscach o szybkim przepływie, w pokarmie spotyka się ponadto larwy chruścików Trichoptera, jętki Ephemeroptera i larwy meszek Simuliidae (Pinchuk i in. 2003 za Elanidze 1956, Grabowska i Grabowski 2006). W Zbiorniku Włocławskim zaobserwowano, że w strefie przybrzeżnej liczebność babki szczupłej wzrasta wieczorem i po zmierzchu, co może być związane z migracjami na żerowiska w płytszych wodach litoralu, ale analiza wypełnienia przewodów pokarmowych nie potwierdziła, że gatunek ten żeruje w nocy (Grabowska i Grabowski 2006). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | Babka szczupła rozprzestrzenia się w Europie wzdłuż dwóch szlaków migracji wodnej fauny ponto-kaspijskiej, opisanych przez Bij De Vaate i in. (2002). Jeden z nich, tzw. centralny, prowadzi z Morza Czarnego przez Dniepr, Prypeć, Kanał Królewski i Muchawiec (będący dopływem Bugu) do Polski, a stąd możliwa jest dalsza ekspansja przez Kanał Bydgoski, Noteć, Odrę do Niemiec i Zachodniej Europy. Zanim gatunek ten dotarł do Polski rozszerzenie jego zasięgu do wysokości Kijowa obserwowano w Dnieprze (Smirnov 1986), oraz w jego dopływach w rejonie Smoleńska (Vasil'eva 2003). Drugi korytarz migracji prowadzi również z Morza Czarnego, ale przez Dunaj. Pierwsze doniesienia o rozszerzaniu zasięgu babki szczupłej tym szlakiem, poza Żelazną Bramą - umowną granicą występowania tej babki, pochodzą z połowy lat 60. (Bănărescu 1970). W ostatnich latach potwierdzono jej występowanie na kilku stanowiskach w serbskim odcinku Dunaju oraz w niektórych jego dopływach, m.in. w Sawie i rzece Czerna (Simonović i in. 2001). Oznacza to, że gatunek ten - choć uznawany za rodzimy dla Serbii - również w tym kraju rozszerza swój zasięg. W 1970 r. złowiono kilka osobników w Balatonie (Biró 1972), a dopiero później w 1984 r. znaleziono ten gatunek w węgierskiej części Dunaju (Pintér 1989). Ekspansja babki szczupłej na Węgrzech nie była dostrzegana do roku 1993, kiedy to jej eksplozyjny pojaw zaobserwowano w zbiorniku zaporowym zlokalizowanym na środkowej Cisie (Harka 1993), a następnie w naturalnym odcinku tej rzeki (Harka 1997). Wkrótce babka szczupła odnotowana została również na Słowacji, w Dunaju na granicy z Węgrami (Stráňai i Andreji 2001), oraz w jego dopływach - Hron, Ipel i Vah (Jurajda i in. 2005).
Kwestią dyskusyjną pozostaje, na ile rozprzestrzenianie się babki szczupłej, podobnie jak innych ponto-kaspijskich babkowatych, w Dunaju i Dnieprze ma charakter naturalnej dyspersji, a na ile wspomagana jest działalnością człowieka. Z jednej strony uznać można, że jest to kontynuacja postglacjalnej migracji z pontyjskiego refugium, a to, że świadkami tego procesu jesteśmy dopiero w ostatnich dziesięcioleciach, wiązać można z antropogenicznymi przekształceniami środowiska, jak np. budowa kanałów łączących zlewiska mórz, budowa zbiorników zaporowych i wreszcie wielokilometrowy transport rzeczny (Ahnelt i in. 1998). Pojaw babki szczupłej w Polsce to właśnie wynik budowy takich kanałów. Babki, będące organizmami bentosowymi i mające słabe zdolności pływania na duże odległości, w swej ekspansji wzdłuż Dunaju mogą wykorzystywać wody balastowe, co sugeruje Ahnelt i in. (1998) i potwierdzają badania Wiesnera (2005), który wykazał, że babki szczególnie licznie zasiedlają rejony umocnień naddunajskich portów w okolicach Wiednia. Na ten rodzaj translokacji wskazuje również przypadek Węgier, gdzie babka szczupła najpierw stwierdzona została w Balatonie, a dopiero 14 lat później w węgierskim odcinku Dunaju.
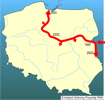
Inwazji tego gatunku sprzyja również szeroki zakres jego tolerancji względem czynników środowiskowych, jak zasolenie czy zmienność diety, oraz typowy dla wszystkich babkowatych behawior rozrodczy (wielomiotowe tarło, ikra składana w ukryciu i pilnowana przez samca), który generuje sukces reprodukcyjny babki szczupłej, a w konsekwencji sprzyja jej ekspansji. Ponieważ ikra składana jest na różnego rodzaju zanurzonych obiektach, doskonałym rodzajem podłoża są również elementy statku, zwłaszcza gdy porośnięte są peryfitonową matą tworzącą zagłębienia, w których mogą podróżować jaja wraz z pilnującym je samcem. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | W Polsce babka szczupła występuje od 1997 r., kiedy to około 50 osobników różnej wielkości złowiono w Bugu na odcinku Terespol - Mężenin (Danilkiewicz 1998). W maju 2002 r. odnotowano jej obecność w Zbiorniku Włocławskim (Kostrzewa i Grabowski 2002). Prowadzone wiosną 2003 r. badania wykazały jej obecność w Bugu poniżej Włodawy i w Zalewie Zegrzyńskim, a zarazem brak tego gatunku w Narwi (Kostrzewa i in. 2004). W 2004 r. babka szczupła dotarła w Wiśle na wysokość 15 km od ujścia do Bałtyku (M. Grabowski - inf. ustna), podczas gdy już rok wcześniej rybacy donosili, że łowiona jest w okolicach Tczewa (K. Skóra - inf. ustna). Zaobserwowano również, że gatunek ten wchodzi w ujściowy odcinek Liwca (dopływ Bugu) (Marszał i in., w przygotowaniu) oraz Bzury (Zięba 2006) i dopływu Wisły - Wdy (M. Grabowski - inf. ustna). W 2007 r. potwierdzono, że gatunek ten utrzymuje się w Bugu na odcinku Terespol - Zalew Zegrzyński oraz Dolnej Wiśle w Zbiorniku Włocławskim (Grabowska - obserwacja własna), stwierdzono go również w Przekopie Wisły (Błażuk - inf. ustna). | | | | | | Występowanie na terenach chronionych | | Gatunek ten stwierdzono w Bugu na odcinkach wchodzących w skład Parku Krajobrazowego "Podlaski Przełom Bugu" oraz Nadbużańskiego Parku Krajobrazowego (Kostrzewa i in. 2004). Ponieważ babka szczupła dotarła w Wiśle poniżej Tczewa, najprawdopodobniej znajduje się również w Zespole Nadwiślańskich Parków Krajobrazowych. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Babka szczupła może pomniejszać bazę pokarmową rodzimych ryb, zwłaszcza gdy jest ona uboga i stanowi obiekt konkurencji. Może również limitująco wpływać na sukces reprodukcyjny krajowych gatunków ryb, poprzez wyjadanie ich ikry i narybku. Jednak w pokarmie babki szczupłej ze Zbiornika Włocławskiego ryby stanowiły mniej niż 3,5% biomasy pokarmu (Kakareko i in. 2005).
Potencjalnie, babka szczupła może być wektorem nowych gatunków pasożytów z rejonu ponto-kaspijskiego. Analiza parazytologiczna przeprowadzona na Słowacji nie potwierdziła tych obaw (Ondračkova in. 2005), jednak najnowsze badania wykazały obecność obcego dla naszej fauny gatunku ektopasożytniczego płazińca, tj. Gyrodactylus proterorhini u osobników złowionych w okolicach Torunia (M. Ondračkova - inf. ustna). Rola babki szczupłej w krajowych biocenozach wodnych nie jest bliżej zbadana. | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Babka ta stwarza pewne zagrożenie dla rodzimego rybostanu ze względu na konkurencję pokarmową i możliwości sprowadzenia egzotycznych pasożytów. Brakuje doniesień o metodach i praktykach zwalczania babki szczupłej. Prawdopodobnie mało skuteczne byłoby wprowadzenie przepisu zabraniającego wędkarzom ponownego wpuszczania do wód raz złapanych osobników babki, jak np. w przypadku trawianki Perccottus glenii, czebaczka Pseudorasbora parva czy sumika karłowatego Ictalurus nebulosus (Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12 listopada 2001 r. (Dz. U. 2001, Nr 138, poz 1559 z późn. zm.). Populacje babki szczupłej mogą natomiast regulować rodzime drapieżniki, jak np. sandacz, sum, miętus czy kormoran, który w Zalewie Wiślanym i Zatoce Puckiej w dużej mierze żeruje na innym gatunku babki - babce byczej Neogobius melanostomus (Bzoma 1998). Omawiany gatunek nie podlega w Polsce żadnej formie ochrony. | | | | | | Prognoza | | Przewidywana jest dalsza ekspansja babki szczupłej na zachód przez Kanał Bydgoski łączący Wisłę z: Notecią, dorzeczem Odry. Stąd może migrować do Niemiec przez system kanałów. Odłów kontrolny na wybranych stanowiskach, prowadzony w październiku 2003 r., jak na razie nie potwierdził obecności tego gatunku w Kanale Bydgoskim i Noteci. Jest bardzo prawdopodobne, że babka szczupła zasiedli również przybrzeżne strefy Bałtyku, skoro złowiona została już 15 km od ujścia Wisły, a ponadto ma fizjologiczne możliwości żyć w wodach o większym zasoleniu niż w Morzu Bałtyckim. | | | | | | Literatura | | - Ahnelt H., Bănărescu P.M., Spolwind R., Harka Á., Waidbacher H. 1998. Occurence and distribution of three gobiid species (Pisces, Gobiidae) in the middle and upper Danube region - examples of different dispersal patterns? Biologia 53 (5): 665-678.
- Bănărescu P.M. 1970. Die Fische des ponto-kaspischen potamophilen Artenkomplex und die karpato-kaukasische Disjunction. Hydrobiologia 11: 135-141. [In German]
- Bij de Vaate A., Jażdżewski K., Ketelaars H., Gollasch S., Van der Velde G. 2002. Geographical patterns in range expansion of macroinvertebrate Ponto-Caspian species in Europe. Canadian Journal of Fisheries and Aquatic Sciences 59: 1159-1174.
- Biró P. 1972. Neogobius fluviatilis in Lake Balaton - a Ponto-Caspian goby new to the fauna of Central Europe. Journal of Fish Biology 4: 249-255.
- Bzoma S. 1998. The contribution of round goby (Neogobius melanostomus Pallas, 1811) to the food supply of cormorants (Phalacrocorax carbo Linnaeus, 1758) feeding in the Puck Bay. Bulletin of the Sea Fisheries Institute 2(144): 3947.
- Danilkiewicz Z. 1998. Babka szczupła, Neogobius fluviatilis (Pallas, 1811), Perciformes, Gobiidae - nowy, pontyjski element w ichtiofaunie zlewiska Morza Bałtyckiego. Fragmenta Faunistica 41 (21): 269-277.
- Grabowska J., Grabowski M. 2006. Diet composition and daily feeding activity of the monkey goby (Neogobius fluviatilis). 14th International Conference on Aquatic Invasive Species, 14-19 may 2006, Key Biscayne, Floryda.
- Harka Á. 1993. Invasion of the Neogobius fluviatilis. Halászat 86 (4): 180-181.
- Harka Á. 1997. Fishes of Hungary. Természet - és Környezetvédő Tanárok Egyesülete, Budapest: 175.
- Janković D.V. 1996. Ichthyofauna of the Danube in the Djerdap Area after the construction of the Iron Gate I Hydroelectric Power System. Acta Universitatis Carolinae, Biologica 40: 123-131.
- Jurajda P., Černy J., Polačik M., Valova Z., Janač M., Blažek R., Ondračkova M. 2005. The recent distribution and abundance of non-native Neogobius fishes in the Slovak section of the River Danube. Journal of Applied Ichthyology 21: 319-323.
- Jurajda P. 2005. Metazoan parasites of Neogobius fishes in the Slovak section of the River Danube. Journal of Applied Ichthyology 21 (4): 345-349.
- Kakareko T., Żbikowski J., Żytkowicz J. 2005. Diet partitioning in summer of two syntopic neogobiids from two different habitats of the lower Vistula River, Poland. Journal of Applied Ichthyology 21: 292- 295.
- Kostrzewa J., Grabowski M. 2002. Babka szczupła Neogobius fluviatilis (Pallas, 1811) w Wiśle - fenomen inwazji pontokaspijskich Gobiidae. Przegląd Zoologiczny 46 (3-4): 235-242.
- Kostrzewa J., Grabowski M., Zięba G. 2004. Nowe inwazyjne gatunki ryb w wodach Polski. Archives of Polish Fisheries 12 (Supplement 2): 21-34.
- Ondračkova M., Dávidová M., Pečinková M., Blažek R., Gelnar M., Valová Z., Čern? J., Pinčuk V.I., Vasil'eva E.D., Vasil'ev V.P., Miller P. 2003. Neogobius fluviatilis (Kessler, 1857). In: Miller P. (ed.) The Freshwater Fishes of Europe. Vol. 8/I Mugilidae, Atherinidae, Atherionopsidae, Blennidae, Odontobutidae, Gobiidae 1. AULA-Verlag: 223-264.
- Pinchuk V.I., Vasil'eva E.D., Vasil'ev V.P., Miller P. 2003. Neogobius fluviatilis (Pallas, 1814). W: Miller P. J. (red.) The Freshwater Fishes of Europe. Vol. 8/I. Mugilidae, Atherinidae, Atherionopsidae, Blennidae, Odontobutidae, Gobiidae 1. AULA-Verlag: 222-252.
- Pintér K. 1989. Fishes of Hungary. Akademia Kiadó, Budapest: 1-202.
- Simonović P., Paunović M., Popović S. 2001. Morphology, feeding and reproduction of the Round Goby, Neogobius melanostomus (Pallas), in the Danube River basin, Yugoslavia. Journal of Great Lakes Resarch 27: 281-289.
- Smirnov A.I. 1986. Perciformes (Gobioidei), Scorpaeniformes, Pleuronectiformes, Gobiesociformes, Lophiiformes. Fauna Ukrainy 8, Ryby (5). Naukova Dumka, Kiev: 1-320.
- Stráňai I., Andreji J. 2004. Monkey goby - still the latest invasive species of family gobidae. Pol'ovnictvo a Rybárstvo 53: 44-45.
- Vasil'eva E. 2003. Mainalteration in ichthyofauna of the larger rivers of the northern coast of the Black Sea in the last 50 years: A review. Folia Zoologica 52 (4): 337-358.
- Wiesner C. 2005. New records of non-indigenous gobies (Neogobius sp.) in the Austrian Danube. Journal of Applied Ichthyology 21: 324-327.
- Zięba G. 2006. Struktura zespołów ryb systemu rzeki Bzury na tle czynników środowiskowych. Rozprawa doktorska, Katedra Ekologii i Zoologii Kręgowców, Uniwersytet Łódzki.
| | | | | | Streszczenie | | It naturally occurs in brackish waters and limans of the Black, Azov and Caspian seas and its rivers: Danube (up to the Iron Gate), Dniestr, Dnieper, Southern Bug, Don, Kuban, Volga and Ural. Till the beginning of the 19th century its occurrence was limited to the lower and middle streches of these rivers and their tributaries. Monkey Goby used two out of the three main invasion corridors. The southern corridor goes along the Danube to the Rhine River. Monkey Goby crossed the Iron Gate and was recorded in the Serbian part of the Danube and its tributaries: Sava and Czerna. In 1970 it was found in Lake Balaton and then in 1984 in the Hungarian part of the Danube. Since 2001 it is present in Slovakia in the Danube and its tributaries: Hron, Ipel and Vah. Through the central corridor covering the route: Dnieper - Vistula - Noteć - Odra and then farther to the Rhine and the North Sea, the species reached Poland where in 1997 it was first recorded in the Bug River (known also as a Western Bug), the tributary of the Vistula River (Baltic Basin). In 2002 it was noted in the Włocławek Reservoir (lower Vistula River) and in 2004 it entered the Vistula River mouth. In this way within seven years Monkey Goby spread 836 km downstream and entered some lower stretches of the Vistula and Bug rivers' tributaries. Studies conducted in 2003 did not show its migration farther to the West, i.e. to the Odra drainage basin. As it is a euryhaline species its expansion from the Vistula River to the coastal waters of the Baltic Sea is also probable.
The invasion of Monkey Goby as well as other Ponto-Caspian gobies might be interpreted as the continuation of postglacial colonization and adaptation to local conditions created after Pleistocene, combined with passive dispersal via water transport, facilitated by man-made changes in lotic ecosystems e.g. damming, alteration of river banks. Moreover, certain biological traits of the Ponto-Caspian gobies, such as phenotypic plasticity, effective reproductive tactics, opportunistic feeding strategy and low parasite load, seem to facilitate their invasion.
Its impact on native ecosystem is unknown. Mokey Goby can reduce food resources of native fish species and compete with them if food is limited. A negative influence on native fish reproductive success is possible through predation on their eggs and fry. Another threat is the introduction of exotic parasites, e.g. Gyrodactylus proterorhini was found in individuals from the Vistula River in the vicinity of the town of Toruń.
There is no information of actions undertaken to prevent its spread or eradicated it from Polish waters. | | | | | | Opracowanie | | Joanna Grabowska | | | | |
|