
Nyctereutes procyonoides (Gray, 1834)
jenot
Raccoon Dog |   | Rodzina | | Canidae psowate | | Rząd | | Carnivora drapieżne | | Gromada | | Mammalia ssaki | | Typ | | Chordata strunowce | | |
 | |  | | | | | | | | |
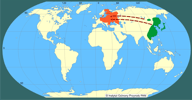
 | | | | | | Pierwotna ojczyzna gatunku | | Daleki Wschód; zasiedla południowo-wschodnią Azję - od dorzeczy Amuru i Ussuri, przez północne Chiny, północny Wietnam, po Koreę i Japonię (Kauhala i Saeki 2004a). | | | | | | Podstawowe cechy morfologiczne | | Jenot jest drapieżnikiem średniej wielkości: długość ciała wynosi 53-69 cm, długość ogona 15-23 cm, a wysokość w kłębie 30-37 cm (R. Kowalczyk - mat. niepubl.). Ciężar ciała dorosłych osobników wiosną wynosi 4,0-7,3 kg; późnym latem i jesienią jenoty gromadzą zapasy tłuszczu, a ich ciężar wzrasta do 4,6-9,1 kg (średnio ok. 7 kg). U gatunku tego nie występuje dymorfizm płciowy (Kauhala 1993, Kauhala i in. 1998). Osobniki jenotów w Europie są większe od osobników ze wschodniej Azji, skąd pochodzą.
Jenot przypomina wyglądem i wielkością szopa pracza lub małego psa. Ma dość długi tułów i krótkie kończyny. Ogon jest stosunkowo krótki, gruby i puszysty. Głowa mała, o krótkim spiczastym pysku i krótkich zaokrąglonych uszach. Po bokach głowy, na policzkach, występują długie włosy tworzące charakterystyczne "bokobrody". Ubarwienie futra jest bardzo zmienne, najczęściej płowo-bure lub brunatno-szare z czarnym nalotem. Na pysku czarna plama obejmująca oczy, policzki i bokobrody, tworząca charakterystyczną maskę. Sierść jest gęsta, długa i puszysta. | | | | | | Biologia, ekologia | | Gatunek monogamiczny; samiec i samica tworzą trwałe pary, zasiedlają wspólny areał i przez większą część roku razem się przemieszczają, żerują, odpoczywają i opiekują potomstwem. Ruja odbywa się w lutym i marcu. Samica rodzi zwykle 7-9 (maks. 16) młodych (Judin 1977, Ward i Wurster-Hill 1990, Kauhala i Helle 1994, Helle i Kauhala 1995, Kauhala 1996a, Kowalczyk i in. 2000, Kauhala i Saeki 2004b). Młode przychodzą na świat na przełomie kwietnia i maja w gnieździe zlokalizowanym zazwyczaj w spróchniałych pniach leżących drzew, norach bądź gęstej roślinności. Po 8 tygodniach młode opuszczają gniazdo, usamodzielniają się w wieku 4-5 miesięcy, a dojrzałość płciową osiągają w wieku 9-11 miesięcy. Średni dystans dyspersji nie przekracza zazwyczaj 20 km, choć zdarzają się wędrówki na odległość ponad 150 km. Na wolności dożywają do ok. 8 lat, jednak średni wiek osobników w populacji nie przekracza zazwyczaj 3 lat (Kauhala i Helle 1994, 1995). Jenoty prowadzą nocny tryb życia, jednak w okresie wychowu młodych są aktywne również w ciągu dnia. W czasie mroźnych zim zmniejszają swoją aktywność i mogą zapadać w stan odrętwienia, trwający nawet kilka tygodni. W okresach ociepleń zimowych wychodzą z nor w poszukiwaniu pokarmu, szczególnie padliny (Sheldon 1992, Jędrzejewska i Jędrzejewski 2001). Jenot jest gatunkiem wszystkożernym, odżywia się głównie padliną, drobnymi ssakami, ptakami i ich jajami, płazami, owadami oraz pokarmem roślinnym (owocami i nasionami) (Kauhala i in. 1993, Jędrzejewska i Jędrzejewski 2001, Baltrunaite 2002). W okresie zimowym, kiedy dostępność różnych źródeł pokarmu jest ograniczona, jenoty odżywiają się przede wszystkim padliną, często odwiedzają też karmniki dla dzików (Jędrzejewska i Jędrzejewski 2001, Selva 2004).
Zagęszczenia jenotów, w zależności od warunków siedliskowych i dostępności pokarmu, mogą się wahać od 5 do 20 osobników/10 km2 (Kowalczyk i in. 2000, Sidorovich in. 2000, Jędrzejewska i Jędrzejewski 2001). Wielkość areałów jenotów jest zmienna w różnych środowiskach i waha się od kilku hektarów do 10 km2 (Kauhala i in. 1993, Kowalczyk i in. 2000). Preferują wilgotne lasy liściaste i mieszane z bogatym podszytem, doliny rzeczne, turzycowiska, brzegi jezior, tereny bagienne i torfowiska (Kauhala 1996b, Jędrzejewska i Jędrzejewski 2001). Występują również w mozaice polno-leśnej (Drygala i in. 2000). Jako schronienia wykorzystują często nory borsuków, czasem lisów. W Puszczy Białowieskiej większość nor użytkowanych przez borsuki jest zasiedlana na zimę przez jenoty (Kowalczyk 2004). Jako kryjówki wykorzystują również spróchniałe pnie rosnących lub zwalonych drzew, wykroty, dziury w korzeniach drzew lub gęste zarośla czy trzciny (Kowalczyk i in. 2000). W obrębie swoich areałów wyznaczają charakterystyczne dla gatunku latryny, regularnie odwiedzane i mające postać kolistego nagromadzenia odchodów lub kopczyków.
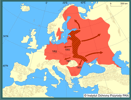
Głównymi przyczynami śmiertelności jenotów jest drapieżnictwo, przede wszystkim ze strony wilków i wałęsających się psów, oraz choroby - głównie wścieklizna i świerzb. Jednym z zachowań jenotów, okazywanych w przypadku zagrożenia, jest "udawanie martwego" (Ward i Wurster-Hill 1990, Sheldon 1992). | | | | | | Okoliczności poprzedzające pojawienie się gatunku w Polsce | | W latach 1928-57 jenoty były introdukowane jako łowne zwierzęta futerkowe na teren europejskiej części byłego Związku Radzieckiego. Pierwsze wpuszczane zwierzęta pochodziły z rosyjskich rejonów dorzecza Amuru i Ussuri. Później jenoty były przesiedlane w nowe miejsca z terenów wcześniejszej udanej introdukcji. W sumie wypuszczono ok. 9 000 osobników. W niektórych obszarach jenoty mogły uciekać z ferm hodowlanych, tworząc nowe populacje (Heltai i in. 2000). Bardzo dobrze zaaklimatyzowały się w środowiskach Europy Wschodniej i dość szybko zaczęły rozprzestrzeniać się w kierunku północnym i zachodnim. W Finlandii notowano je po raz pierwszy w 1935 r., w Szwecji - w latach 1945-46, Rumunii - 1952, Polsce - 1955, Słowacji - 1959, Niemczech i na Węgrzech - w latach 1961-62, Norwegii - w roku 1983 (Nowak i Pielowski 1964, Kauhala 1996c). Pojawiły się także w Bułgarii i Mołdawii. Sporadycznie notowane są w Austrii, Bośni, Danii, Francji, Holandii, Słowenii, Szwajcarii i we Włoszech (Kauhala i Saeki 2004a).
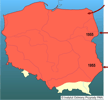
Od 1935 do 1984 roku jenoty skolonizowały obszar liczący ponad 1 400 000 km2. Głównymi czynnikami sprzyjającymi ich rozprzestrzenieniu są: 1) duża plastyczność w adaptacji do różnych warunków środowiskowych i klimatycznych, 2) możliwości zapadania w sen zimowy podczas mroźnych zim, 3) wysoka rozrodczość, 4) zdolność migracyjna, 5) wszystkożerność. | | | | | | Ekspansja/inwazja w Polsce, czas i miejsce | | Jenoty dotarły do Polski z Białorusi, Litwy i Ukrainy. Po raz pierwszy zanotowano je w 1955 roku w Puszczy Białowieskiej oraz okolicach Hrubieszowa na Zamojszczyźnie (Dehnel 1956). Początkowo zasiedlały północno-wschodnią Polskę, a następnie stopniowo przesuwały swój areał w kierunku zachodnim i południowo-zachodnim. W latach 1957-60 jenoty pojawiły się na Suwalszczyźnie, Pojezierzu Mazurskim oraz w okolicach Łomży. Do 1963 r. pojedyncze osobniki notowane były we wszystkich ówczesnych województwach na terenie kraju (Nowak i Pielowski 1964). Do lat 80. liczniej występowały w północno-wschodniej Polsce (obecne województwa podlaskie, warmińsko-mazurskie i lubelskie). Od początku lat 90. następował wzrost zagęszczeń na północy i wschodzie kraju (Pomorze i Polesie). W latach 90. zasiedlił Puszczę Niepołomicką (Z. Głowaciński - mat. niepubl.), zaś w pierwszych latach XX stulecia notowany w granicach Krakowa (H. Okarma - mat. niepubl.).
Obecnie jenot występuje prawie w całej Polsce, z wyjątkiem Karpat. Tylko pojedyncze obserwacje tego gatunku pochodzą z pogórzy karpackich, np. z pogórza Beskidu Sądeckiego, czy też z Pogórza Dynowskiego. Jest pozyskiwany łowiecko na terenie całego kraju, z wyjątkiem okręgów łowieckich Nowego Sącza i Przemyśla (dane Stacji Badawczej PZŁ w Czempiniu), gdzie jednak w lipcu 2007 r. obserwowano jenota w lesie k. Ustrzyk Dolnych (B. i C. Ćwikowscy - inf. korespond.). | | | | | | Występowanie na terenach chronionych | | Jenoty występują na terenie większości polskich parków narodowych i rezerwatów przyrody, osiągając szczególnie wysokie zagęszczenia na obszarach podmokłych obfitujących w ptaki wodno-błotne, takich jak Biebrzański PN i PN "Ujście Warty". Jenoty nie występują lub występują tylko sporadycznie w górskich parkach narodowych. Obok lisa Vulpes vulpes i norki amerykańskiej Mustela vison, jenot jest jednym z najczęściej spotykanych średnich drapieżników w niektórych lesistych obszarach kraju, w tym na obszarach chronionych. | | | | | | Wpływ na ekosystemy i gatunki rodzime | | Ekologia jenota i jego oddziaływanie na rodzimą faunę są bardzo słabo zbadane. Nisza pokarmowa tego gatunku jest znacznie szersza niż innych krajowych ssaków drapieżnych (Jędrzejewska i Jędrzejewski 2001), z którymi skutecznie konkurują. Jenoty wyrządzają bliżej nieoszacowane szkody w koloniach lęgowych ptaków wodnych i wodno-błotnych, mogą również być czynnikiem ograniczającym populacje kuraków leśnych (V. Sidorovich - mat. niepubl.) oraz stanowić zagrożenie dla lokalnych populacji płazów (Kauhala 1996c). Z obserwacji pochodzących z Finlandii, latem 2-67% odchodów jenotów zawierało resztki ptactwa wodnego (głównie edredona Somateria mollissima), ale prawdopodobnie były to ptaki padłe. Stwierdzono, że jenoty zabijały jedynie do 4% wysiadujących samic edredona. W obszarze tym 11-40% odchodów jenotów zawierało skorupy jaj ptaków, co świadczy o niszczeniu lęgów przez te drapieżniki (Kauhala i Auniola 2001). Jako gatunek o szerokim spektrum zjadanego pokarmu, jenot może konkurować z rodzimymi gatunkami drapieżników średniej wielkości, szczególnie z lisem i borsukiem. W niektórych rejonach, jako bardzo efektywny padlinożerca (Selva 2004), może obniżać dostępność padliny (ważnego źródła pokarmu na przełomie zimy i wiosny) i wpływać na zagęszczenia i przeżywalność innych drapieżników (Sidorovich i in. 2000). | | | | | | Szkodliwość, profilaktyka i zwalczanie | | Zasiedlanie przez jenoty nor borsuków zimą i w sezonie rozrodczym może prowadzić do przenoszenia pasożytów i chorób (Kowalczyk i in. 2000, R. Kowalczyk - mat. niepubl.). Jenoty są nosicielami wścieklizny, świerzbu, bąblowców Echinococcuss multilocularis i włośni Trichinella sp.(Westerling 1991, Oivanen i in. 2002). W Finlandii wykazano związek między zagęszczeniami jenotów a poziomem zapasożycenia rysi Lynx lynx przez larwy włośni (Oksanen i in. 1998). Jenoty często są zabijane przez duże drapieżniki i wałęsające się psy, co może prowadzić do zarażania tych zwierząt chorobami zakaźnymi i pasożytami.
W Europie jenoty są jednym z głównych wektorów roznoszenia chorób i pasożytów groźnych również dla człowieka. W latach 90. w Polsce, na Litwie, w Łotwie i Estonii w 16% wszystkich przypadków wścieklizny. W ostatnich latach w Estonii jenoty stanowiły ponad 50% przypadków wścieklizny u dzikich zwierząt. W Polsce w latach 1999-2004 ponad 700 jenotów (ok. 8% wszystkich przypadków) było zarażonych wścieklizną. W czasie epidemii wścieklizny w Finlandii w późnych latach 80. 77% przypadków wścieklizny notowano u jenotów (Westerling 1991).
W Rekomendacji nr 77 Konwencji Berneńskiej jenoty są wymieniane pośród gatunków inwazyjnych, stanowiących zagrożenia różnorodności biologicznej i powinny podlegać zwalczaniu.
Lokalnie, np. na terenach chronionych i w ostojach ptaków, wskazany jest intensywny odłów jenotów w pułapki klatkowe i polowanie z psami. Jednak - ze względu na ich skryty tryb życia, wysokie zagęszczenia, szerokie rozprzestrzenienie i wysoki potencjał rozrodczy - ograniczanie liczebności jenotów w praktyce jest mało efektywne. W niektórych krajach Europy, jak Estonia, Litwa, Łotwa, Norwegia czy Szwecja, przeciwdziała się ekspansji jenotów i innych obcych gatunków przez ich całoroczny odstrzał. W Polsce jenot jest gatunkiem łownym (Dz. U. 2005, Nr 45, poz. 433) z okresem polowań od 1 lipca do 31 marca, a na terenach obwodów łowieckich, w których występuje głuszec lub cietrzew - przez cały rok. Poziom pozyskania jenotów w Polsce wynosi 6 000-10 000 osobników rocznie i stopniowo wzrasta (dane Stacji Badawczej PZŁ w Czempiniu). Dla porównania w Finlandii pozyskuje się rocznie 75 000-130 000 jenotów (Kauhala i Saeki 2004a; K. Kauhala - inf. ustna). | | | | | | Prognoza | | Jenot najprawdopodobniej będzie kontynuował zasiedlanie nowych terenów Europy i powiększał swoją liczebność. Duża plastyczność w przystosowaniu się do zróżnicowanych warunków środowiskowych, w tym terenów rolniczych, skutkować będzie zasiedlaniem obszarów także silniej zagospodarowanych. Dalszej ekspansji sprzyjać będzie także ocieplenie klimatu (długie i mroźne zimy były czynnikiem ograniczającym występowanie jenota), przy mało skutecznej interwencji łowieckiej. | | | | | | Literatura | | - Baltrunaite L. 2002. Diet composition of the red fox (Vulpes vulpes L.), pine marten (Martes martes L.) and raccoon dog (Nyctereutes procyonoidesGray) in clay plain landscape, Lithuania. Acta Zoologica Lituanica 12: 362-368.
- Dehnel A. 1956. Nowy ssak dla fauny polskiej Nyctereutes procyonoide (Gray). Chrońmy Przyrodę Ojczystą 12 (6): 17-21.
- Drygala F., Mix H.M., Stier N., Roth M. 2000. Preliminary findings from ecological studies of the racoon dog (Nyctereutes procyonoides) in Eastern Germany. Zeitschrift für Ökologie und Naturschutz 9: 147-152.
- Helle E., Kauhala K. 1995. Reproduction in the raccoon dog in Finland. Journal of Mammalogy 76: 1036-1046.
- Heltai M., Szemethy L., Lanszki J., Csanyi S. 2000. Returning and new mammal predators in Hungary: the status and distribution of the golden jackal (Canis aureus), raccoon dog (Nyctereutes procyonoides) and raccoon (Procyon lotor) in 1997-2000. Beiträge zur Jagd- und Wildforschung 26: 95-102.
- Jędrzejewska B., Jędrzejewski W. 2001. Ekologia zwierząt drapieżnych Puszczy Białowieskiej. Wydawnictwo Naukowe PWN, Warszawa.
- Judin V.G. 1977. Enotovidnaja sobaka Primoria i Priamuria. Izd. Nauka, Moscow, Russia.
- Kauhala K. 1993. Growth, size, and fat reserves of the raccoon dog in Finland. Acta Theriologica 38: 139-150.
- Kauhala K. 1996a. Reproductive strategies of the raccoon dog and the red fox in Finland. Acta Theriologica 41: 51-58.
- Kauhala K. 1996b. Habitat use of raccoon dogs, Nyctereutes procyonoides, in southern Finland. Zeitschrift für Säugetierkunde 61: 269-275.
- Kauhala K. 1996c. Introduced carnivores in Europe with special reference to central and northern Europe. Wildlife Biology 2: 197-204.
- Kauhala K., Auniola M. 2001. Diet of raccoon dogs in summer in the Finnish archipelago. Ecography 24: 151-156.
- Kauhala K., Helle E. 1994. Home ranges and monogamy of the raccoon dog in southern Finland. Suomen Riista 40: 32-41.
- Kauhala K., Helle E. 1995. Population ecology of the raccoon dog in Finland - a synthesis. Wildlife Biology 1:3-9.
- Kauhala K., Saeki M. 2004a. Raccoon dogs. In: Sillero-Zubiri C. Hoffmann M., Macdonald D.W. (eds); Canids: Foxes, Wolves, Jackals and Dogs. Status Survey and Conservation Action Plan. IUCN/SSC Canid Specialist Group, Gland, Switzerland and Cambridge, (UK): 136-142.
- Kauhala K., Saeki M. 2004b. Raccoon dogs. Finnish and Japanese raccoon dogs - on the road to speciation? In: Mac Donald D.W., Sillero-Zubiri C. (eds) Biology and conservation of wild canids. Oxford University Press, Oxford, UK: 217-226.
- Kauhala K., Helle E., Taskinen K. 1993. Home range of the raccoon dog (Nyctereutes procyonoides) in southern Finland. Journal of Zoology (London) 231: 95-106.
- Kauhala K., Kaunisto M., Helle E. 1993. Diet of the Raccoon dog, Nyctereutes procyonoides, in Finland. Zeitschrift für Säugetierkunde 58: 129-136.
- Kauhala K., Laukkanen P., Von Rege I. 1998. Summer food composition and food niche overlap of the raccoon dog, red fox and badger in Finland. Ecography 21: 457-463.
- Kauhala K., Viranta S., Kishimoto M., Helle E., Obara I. 1998. Skull and tooth morphology of Finish and Japanese raccoon dogs. Annales Zoologici Fennici 35:1-16.
- Kowalczyk R. 2004. Borsuki - w poszukiwaniu dżdżownic. W: Jędrzejewska B., Wójcik J.M. (red.) Eseje o ssakach Puszczy Białowieskiej. Zakład Badania Ssaków Polskiej Akademii Nauk, Białowieża: 93-102.
- Kowalczyk R., Zalewski A., Jędrzejewska B., Jędrzejewski W. 2000. Jenot - ni pies ni borsuk. Łowiec Polski 11: 19-20.
- Nowak E., Pielowski Z. 1964. Die Verbreitung des Marderhundes in Polen im Zusammenhang mit seiner Einbürgerung und Ausbreitung in Europa. Acta Theriologica 9: 81-110.
- Oivanen L., Kapel C.M.O., Pozio E., La Rosa G., Mikkonen T., Sukura A. 2002. Associations between Trichinellaspecies and host species in Finland. Journal of Parasitology 88: 84-88.
- Oksanen A., Lindgren E., Tunkkari P. 1998. Epidemiology of trichinellosisin lynx in Finland. Journal of Helminthology 72: 47-53.
- Selva N. 2004. Ssaki kopytne i padlinożercy. W: Jędrzejewska B., Wójcik J.M. (red.) Eseje o ssakach Puszczy Białowieskiej. Zakład Badania Ssaków Polskiej Akademii Nauk, Białowieża: 59-68.
- Sheldon J. 1992. Wild Dogs: The Natural History of the Nondomestic Canidae. Academic Press, San Diego.
- Sidorovich V.E., Polozov A.G., Lauzhel G.O., Krasko D.A. 2000. Dietary overlap among generalist carnivores in relation to the impact of the introduced raccoon dog Nyctereutes procyonoides on native predators in northern Belarus. Zeitschrift für Säugetierkunde 65: 271-285.
- Ward O., Wurster-Hill D. 1990. Mammalian Species: Nyctereutes procyonoides. American Society of Mammalogists 358: 1-5.
- Westerling B. 1991. Rabies in Finland and its control 1988-90. Suomen Riista 37: 93-100.
| | | | | | Streszczenie | | Raccoon Dog Nyctereutes procyonoides is a medium-sized carnivore, which originally has come from south-eastern Asia. The native range of the species covers large parts of China, north-east Indochina, Korea, eastern Siberia and Japan. After introduction to the European part of the former Soviet Union in 1920s-1950s as a fur game species, Raccoon Dogs spread over eastern, central and northern Europe. From 1935 to 1984, they have colonized, by natural expansion, 1.4 million km2 of Europe and in some areas they became the most numerous carnivores. Factors which enabled raccoon dogs to expand and inhabit large areas of Europe was high reproductive capacity, great plasticity in adaptation to various climatic and environmental conditions (winter sleep is observed during severe winters), migratory ability (up to 150 km), omnivorousness and limited human management. For the first time Racoon Dog was observed in Poland in 1955 and till 1990s it invaded almost the whole of Poland, except for the higher parts of the Carpathians. Raccoon Dogs are most numerous in the north-eastern and north-western part of the country. They prefer wet deciduous and mixed forests, river valleys, lake shores and marshes.
Raccoon Dogs are monogamous animals. The male and female often forage, rest and take care of young together. Females deliver 7-9 pups, on average, usually in burrows (often badgers setts), hollow trees or in dense vegetation. Young disperse in August-September and mature when 9 months old. Annual mortality is very high (over 60%), especially among young individuals. Main sources of their mortality are predation (mainly from wolves and dogs) and diseases (mainly rabies and sarcoptic mange). Raccoon Dogs collect fat-reserves in autumn and spend cold winters usually in badger setts, hollow trees or beaver lodges.
There is no data unequivocally confirming the negative impact of raccoon dogs on native species. Locally they may cause severe damage to waterfowl colonies, tetraonid birds and amphibians. Raccoon Dogs are omnivorous carnivores and efficient scavengers and may potentially compete with the native species of medium-sized carnivores such as red fox (Vulpes vulpes) and badger (Meles meles), and other scavengers. Raccoon Dogs are important vectors of rabies, sarcoptic mange, Echinococcuss multilocularis and trichnellosis.
Despite a high mortality rate, the life strategy of Raccoon Dogs makes them ideally suited to invading new areas. Western Europe seems to be an especially suitable area due to absence of large predators and elimination of rabies (oral vaccination programs). The further expansion of Racoon Dog and an increase in its numbers in the previously invaded areas is predicted. The possibilities of Raccoon Dog control are limited due to its secretive life, winter inactivity, high reproductive capacity, high densities, wide distribution, and the low interest of hunters in this species. | | | | | | Opracowanie | | Rafał Kowalczyk | | | | |
|